Краюшкин Павел Владимирович
Врач-биохимик, директор по медицине компании Premium Aesthetics, Москва
Искусственный интеллект (ИИ) активно внедряется в современную жизнь, и медицина не является исключением. Специализированный ИИ лучше всего подходит для визуальной диагностики, например для раннего выявления меланомы. В некоторых исследованиях решения на основе ИИ продемонстрировали чувствительность и специфичность, сравнимые с таковыми у опытных клиницистов и даже превосходящие их.
В статье раскрывается суть понятия «искусственный интеллект». Описываются возможности ранней диагностики меланомы и других онкологических заболеваний на примере работы автоматизированной системы скрининга рака кожи, функционирующей совместно с сервисом искусственного интеллекта.
Ключевые слова: искусственный интеллект, меланома, ранняя диагностика меланомы, дерматоскопия, ATBM, Moleanalyzer
Идея заменить человека своим искусственным подобием не является новой и современной — над этим вопросом люди задумывались с давних времен. В поэме Гомера «Илиада» бог огня Гефест ковал человекоподобных существ, прислуживавших ему и выполнявших простые работы:
Он под подножием их золотые колеса устроил.
Сами собою они приближалися к сонму бессмертных,
Сами собою и в дом возвращалися, взорам на диво.
В сем они виде окончены были; одних не приделал
Кованых ручек — гвозди готовил к ним.
И сколь бы фантастичными ни выглядели подобные решения, они частично находили свое реальное воплощение. Например, в Древнем Египте была создана механическая статуя бога Амона — ее периодическое «оживление» оказывало сильное впечатление на верующих [1]. Открытия науки и техники позволили человечеству приблизиться к тому, что сегодня называется искусственным интеллектом (ИИ).
Родоначальником ИИ считается средневековый испанский философ, математик и поэт Раймунд Луллий, который в XIII в. попытался создать механическую машину для решения различных задач на основе разработанной им всеобщей классификации понятий.
В дальнейшем эта идея была развита Рене Декартом и Готфридом Лейбницем, которые независимо друг от друга предложили универсальные языки классификации всех наук [1]. Окончательное рождение ИИ как научного направления произошло в 40-х гг. XX в. после изобретения первой электронно-вычислительной машины (ЭВМ).
Термин «искусственный интеллект» (Artificial Intelligence) был предложен в 1956 г. американским информатиком Джоном Маккарти на семинаре в Дартмутском колледже (США). В то время он звучал так: «ИИ — это способность к обучению или любая другая особенность интеллекта, которые можно описать настолько точно, чтобы в дальнейшем создать для их имитации соответствующую машину» [1].
Более современное определение ИИ дал основатель лаборатории по изучению искусственного интеллекта на правах рекламы Массачусетского технологического колледжа Марвин Ли Минский: «Искусственный интеллект — это наука, специализирующаяся на обучении машин таким действиям, которые при выполнении людьми требуют наличия интеллекта» [2]. Сегодня также встречаются следующие версии:
Все искусственные интеллекты можно разделить на 2 типа, обладающие принципиальными отличиями друг от друга.
Возможности специализированного искусственного интеллекта значительно расширяются при использовании нейросетей.
Перед разговором о нейронных сетях стоит упомянуть такое определение, как машинное обучение (machine learning) — это наука о том, как заставить компьютеры действовать, не будучи напрямую запрограммированными на данную работу. Проще говоря, это способность машин «делать выводы» и «принимать решения», исходя из поступающей информации [3].
На данном принципе строится искусственная нейронная сеть (artificial neural network), которая является одним из основных инструментов машинного обучения. Она обладает входным, выходным и (в большинстве случаев) несколькими скрытыми уровнями, которые преобразуют поступающие извне сигналы для их использования на выходном уровне (рис. 2).
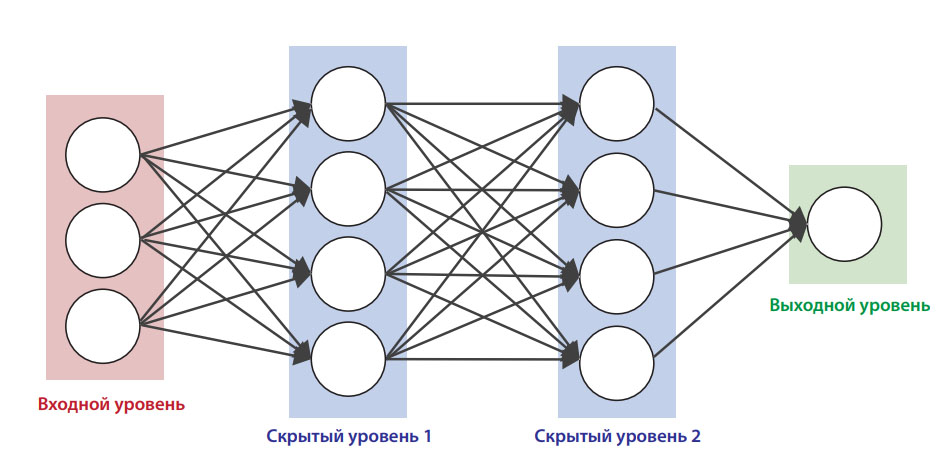
Рис. 2. Принцип работы искусственной нейронной сети
Нейронная сеть получила свое название благодаря структуре, которая напоминает организацию нейронов в головном мозге. Искусственная нейросеть состоит из «виртуальных нейронов», каждый нейрон является логическим блоком, который получает входную информацию, принимает на ее основе решение, передает его дальше и в обязательном порядке получает обратную связь – информацию о том, правильным было это решение или нет. Если решение верное, то «виртуальный нейрон» получает больший вес среди всех остальных «нейронов» сети, и его последующие решения будут иметь большее значение. Напротив, если итоги оказались неверными, то вес «виртуального нейрона» в сети уменьшается.
Искусственная нейронная сеть состоит из множества нейронов, которые образуют слои. В каждом слое или на каждом уровне принятия решений в процессе обучения постепенно «отбираются» нейроны, которые находили правильные решения, и «исключаются» те, чьи выводы оказывались неверными. Искусственная нейронная сеть — это один из самых эффективных и распространенных способов машинного обучения, она используется в системах распознавания изображений. Например, распознавание лиц на фотографии в социальных сетях — это демонстрация работы нейросети.
Искусственный интеллект на основе нейросетей активно используется и для распознавания изображений, полученных в медицинских целях. Например, в дерматоонкологии распознаванию подвергаются цифровые изображения, полученные при помощи дерматоскопа или фотоаппарата. Цифровое изображение каждого новообразования состоит из нескольких миллионов пикселей (точек), каждый из которых окрашен в один из миллионов цветов. Превалирование того или иного цвета на снимке, характер распределения пикселей определенного цветового диапазона, а также размер и форма областей, на которых распределены данные точки, — все это, по сути, является диагностическими признаками, позволяющими отличить на микрофотографии злокачественное новообразование от доброкачественного.
Работа искусственного интеллекта, анализирующего такое изображение, чрезвычайно сложна и складывается из деятельности множества «виртуальных нейронов» и организованных из них слоев. Например, первый слой анализирует яркость отдельных пикселей изображения. Следующий слой идентифицирует форму элементов новообразований, основываясь на группировке схожих по яркости пикселей. Далее подобным образом распознается текстура, площадь новообразований и т. д. К моменту достижения четвертого или пятого слоя нейросеть уже «понимает», с какими кожными патологиями она имеет дело, и занимается распознаванием сложных признаков, например степени злокачественности меланомы [3].
Для успешного обучения нейросети необходимы примеры правильных решений. В дерматоскопии это микрофотографии новообразований, для которых гистологически установлен диагноз. Если нейросеть обучать на тысячах таких снимков, каждый раз улучшая ее работу, то конечный результат может оказаться сопоставимым с осмотром опытного дерматоонколога. В этом смысле обучение искусственной нейросети напоминает обучение человека. Но принципиальное отличие ИИ от человеческого разума заключается в том, что он ничего не забывает, ему незнакома усталость или потеря внимания – он работает намного быстрее и, главное, способен функционировать 24 часа в сутки.
Нейронные сети, основанные на специализированном искусственном интеллекте, сегодня активно используются во многих отраслях — не так давно они пришли и в медицину. Рассмотрим, в какой степени такой ИИ может реализовать когнитивные задачи, традиционно выполняемые врачами.
Британская медицинская ассоциация считает, что способность правильно выставить диагноз «…является главной отличительной чертой врачей относительно других работников системы здравоохранения» [4]. Однако эта «уникальная» роль очень часто заключается в последовательном распознавании образов в рамках определенного алгоритма. Специалист собирает информацию, анализирует ее и сравнивает с изученными ранее категориями (симптомами). Если у пациента клиническая картина и результаты исследований совпадают с данными по известным заболеваниям, врач классифицирует патологию и делает соответствующее заключение. Очевидно, что этот процесс может выполняться специализированным ИИ, — такие решения уже существуют [5].
Например, компания IBM разработала суперкомпьютер с искусственным интеллектом Watson (Ватсон), способный воспринимать, «понимать» и принимать решения на основе естественного языка. Его возможности используются в Мемориальном Раковом центре Слоун-Кеттеринг (Memorial Sloan Kettering Cancer Centre, Нью-Йорк) для оказания помощи в диагностике онкологических заболеваний и разработке планов терапии пациентов [6]. В отличие от людей, которые могут учиться только на собственном опыте и опыте своих коллег, а также приобретать знания из десятков или сотен источников, Watson ежедневно анализирует миллионы медицинских отчетов, записей пациентов, клинических испытаний и медицинских журналов. Причем он делает это 24 часа в сутки, без сна и отдыха. По словам главного исследователя Дэвида Ферруччи, искусственный интеллект Watson в определенных ситуациях уже превосходит опытных медиков [7].
Нельзя не упомянуть и про различные Системы поддержки клинических решений (Clinical Decision Support System, CDSS), обладающие собственным ИИ. В одном из исследований онлайн-версия CDSS Isabel (Изабель) при анализе данных 50 пациентов поставила верный диагноз в 96% случаев [8]. Этот результат превзошел человеческий, поскольку люди правильно диагностировали патологии в среднем у 95% амбулаторных пациентов [9].
Особенно хорошо поддаются анализу ИИ медицинские данные в виде изображений, которые используются в диагностике различных заболеваний. В одной из работ специалисты научили искусственный интеллект распознавать диабетическую ретинопатию. В итоге при смешанном анализе нормальных и патологических изображений ИИ продемонстрировал число ошибок, сопоставимое с человеческим [10]. В другом исследовании разработанный в Университете Малайи (Малайзия) алгоритм при изучении 340 изображений МРТ головного мозга находил патологии со 100-процентной точностью [11].
Интересные данные были получены при анализе искусственным интеллектом почерка пациентов. Изучая рукописный текст, алгоритм компьютерного зрения с точностью в 79% разделил 55 пациентов на «здоровых» и «имеющих признаки болезни Паркинсона» [12].
Вышеописанные примеры ИИ предназначены для помощи врачам, а не для самостоятельной работы. Однако полученные результаты имеют огромное значение, поскольку диагностика с использованием систем искусственного интеллекта уже в ближайшем будущем будет выполняться лучше, быстрее и дешевле. Со временем ИИ сможет заменить человека во многих «визуальных» медицинских областях – рентгенологии, офтальмологии и, конечно же, дерматоскопии.
Искусственный интеллект хорошо показал себя не только при выставлении диагноза, но и в назначении лечения. Это связано с тем, что терапия наиболее распространенных заболеваний в большинстве своем является набором алгоритмов. Для этого уже сегодня в мире используются CDSS, которые варьируют от простых информационных ресурсов до интеллектуальных алгоритмов, предлагающих пациентам индивидуальные рекомендации по лечению [13].
Например, применение алгоритма Анализа резистентности к антибиотикам и эпидемиологического контроля (Antimicrobial Resistance Utilisation and Surveillance Control, ARUSC), связанного с электронной медицинской картой, помогает врачам назначать противомикробные препараты, которые будут эффективными у конкретных больных. В недавнем проспективном когортном исследовании в Сингапуре выяснилось, что использование ARUSC вдвое снизило смертность у пациентов, изначально пролеченных на эмпирически назначенных антибиотиках [14]. Очевидно, что при принятии решения о выборе той или иной схемы терапии объединенные возможности врача и машины превосходят человеческого специалиста.
Однако вернемся к дерматологии – эта «визуальная» область медицины, как было показано выше, хорошо под- ходит для анализа искусственным интеллектом. И такие решения уже существуют, например, для ранней диагностики меланомы.
Эпидемиология и этиология меланомы
Медицинская и социальная значимость меланомы определяется ростом заболеваемости, высоким злокачественным потенциалом, ранним метастазированием, частым возвратом болезни после лечения и высокой долей лиц, заболевающих в трудоспособном возрасте.
В европейском регионе стандартизованные уровни заболеваемости меланомой кожи варьируют в достаточно широких пределах — от 4,0 до 20,3 случаев на 100 000 населения (данные ВОЗ, GLOBOCAN 2012) [14]. Наиболее высокая заболеваемость меланомой отмечена в Швейцарии, Нидерландах, Дании, Швеции и Великобритании. Интересно, что в Польше, Литве, Латвии, Украине и России данный показатель в 3–4 раза ниже [15].
На других континентах ситуация сильно варьирует, хотя прослеживаются явные этнические различия в заболеваемости. Например, в Индии и Японии с высоким уровнем инсоляции, но в основном коренным населением заболеваемость меланомой низкая (0,2–0,6 случаев на 100 000 населения). В то же время в Израиле и США с большим числом светлокожих мигрантов и высокой дозой ультрафиолетового излучения заболеваемость высокая (11,4–14,3 случаев на 100 000 населения), но значительно ниже, чем в Нидерландах и Дании. Максимальная заболеваемость меланомой отмечена в Австралии – 34,9 случаев на 100 000 населения [15].
Наиболее значимым фактором риска развития меланомы считается избыточное ультрафиолетовое облучение в сочетании с генетической предрасположенностью: светлой, восприимчивой к солнечным ожогам кожей, большим числом меланоцитарных невусов, синдромом семейных атипических невусов (FAMM-синдром) и терминальными мутациями в генах регуляции клеточного цикла CDKN2A и CDK4 [16, 17].
Однако не только инсоляция может провоцировать развитие данной патологии кожи. В исследовании шведских ученых на основе данных канцеррегистра была выявлена статистически значимая связь между заболеваемостью меланомой и работой в помещении. При этом опухоль возникала преимущественно на закрытых одеждой участках тела, тогда как для открытых участков подобной зависимости не зафиксировано [18].
Меланому отличает склонность к раннему и достаточно активному метастазированию. Чаще всего поражаются регионарные лимфатические узлы, могут возникать внутрикожные метастазы [19]. Установлено, что своевременная диагностика меланомных невусов имеет огромное значение для выживаемости пациентов (табл. 1).
Таблица 1. Зависимость выживаемости пациентов от стадии диагностики меланомы (данные American Cancer Society) [20]
| Стадия меланомы | 5-летняя выживаемость | 10-летняя выживаемость |
| IA | 97% | 95% |
| IB | 92% | 86% |
| IIA | 81% | 67% |
| IIB | 70% | 57% |
| IIC | 53% | 40% |
| IIIA | 78%* | 68%* |
| IIIB | 59% | 43% |
| IIIC | 40% | 24% |
| IV | 15–20% | 10–15% |
* Коэффициент выживаемости для стадии IIIA выше, чем для некоторых видов меланомы стадии II
Первоначальная диагностика меланомы кожи практически всегда основывается на визуальной оценке новообразования. Для этого разработаны различные методы, каждый из которых имеет свои преимущества и недостатки.
Методы визуализации в дерматологии
Визуализация поверхности кожи в дерматологии играет решающую роль в оценке и мониторинге рака кожи. Хотя клиницисты в первую очередь полагаются на свое зрение, для повышения его возможностей были созданы различные методы (табл. 2).
Цифровая фотография используется в среднем 82,2% американских дерматологов для постановки диагноза и динамического наблюдения [22]. Этот метод способствует раннему выявлению меланомы у пациентов группы высокого риска [23]. Разновидностью цифровых снимков является ультрафиолетовая фотография в определенном УФ-диапазоне.
Общий снимок тела (total-body photography, TBP) подразумевает выполнение от 4 до 50 (в среднем 24) фото пациента в нескольких ракурсах [24]. Дополнение TBP к самоанализу кожи повышает суммарную эффективность методов с 60 до 72% и увеличивает специфичность диагностики с 96 до 98% [25].
Таблица 2. Сравнение различных методов визуализации в дерматологии [21]
| Метод визуализации | Преимущества | Недостатки |
| Цифровая фотография | Простой и недорогой метод, который позволяет хранить информацию длительное время. | Фиксирует морфологию поверхности кожи, но не глубоких ее слоев. |
| Общий снимок тела (Total body photography, TBP) | Упрощает документирование, подходит для самообследования кожи. 3D-TBP создает трехмерную модель человека, позволяя улучшить визуализацию. Можно использовать для долгосрочного мониторинга. | Процедура занимает много времени. |
| Ультрафиолетовая фотография | Ультрафиолетовые снимки помогают оценивать степень фотоповреждения кожи. | Возможны ложноположительные и ложноотрицательные результаты. |
| Дерматоскопия | · Использует 10-кратное или 20-кратное увеличение для диа- гностики широкого спектра дерматологических заболеваний.· Подходит для долгосрочного мониторинга.
· Имеются четкие критерии диагностики рака кожи, которые хорошо коррелируют с его гистопатологическими особенностями. |
· Обладает ограниченной кратностью увеличения.· Требует надлежащей подготовки специалистов и определенного опыта.
· Интерпретация результатов в большинстве случаев субъективна. |
| Отражательная конфокальная микроскопия | · 30-кратное увеличение позволяет визуализировать микроскопические структуры.· Исследует кожу до сосочкового слоя дермы.
· В некоторых случаях может заменить биопсию. · Облегчает дифференциальную диагностику. · Подходит для долгосрочного мониторинга. |
· Не позволяет работать со структурами, лежащими ниже сосочкового слоя дермы.· Требует надлежащей подготовки специалистов и определенного опыта. |
| Оптическая когерентная томография | · Высокое разрешение позволяет визуализировать очень мелкие структуры (3–15 мкм).· Обладает большой глубиной исследования — до 1,5 мм.
· Создает двух- и трехмерные изображения. · В некоторых случаях может заменить биопсию. · Может сочетаться с другими методами, включая доплеровское сканирование. |
· Дорогой метод.· Требует надлежащей подготовки специалистов и определенного опыта.
· Не всегда позволяет дифференцировать доброкачественные и злокачественные новообразования. |
Автоматическое тотальное картирование тела (Automated Total Body Mapping, ATBM) — разновидность TBP, позволяющая делать снимок тела в автоматическом режиме и сравнивать фотографии одного и того же участка с использованием компьютерного алгоритма. Данный метод позволяет выявить вновь появившиеся новообразования путем сопоставления актуального и предыдущего снимка. Является эффективным методом выявления меланомы de novo у пациентов с большим количеством невусов.
Дерматоскопия использует 10- и более кратное увеличение для выявления широкого спектра дерматологических заболеваний. Снимки, выполненные с помощью дерматоскопа, можно сохранять для дальнейшего наблюдения.
Таблица 3. Среднее число обследованных дерматологами пациентов и время ожидания приема (данные Хорватского фонда медицинского страхования, 2015–2016 гг.) [26]
| Тип обследования у дерматолога |
Октябрь 2015 г. |
Октябрь 2016 г. |
||
| Число назначенных обследований, шт. | Среднее время ожидания приема врача, сут | Число назначенных обследований, шт. | Среднее время ожидания приема врача, сут | |
| Первичный прием |
4678 |
48 | 5329 | 57 |
| Повторный прием (онкология) | 359 | 90 | 302 | 79 |
Отражательная конфокальная микроскопия (reflectance confocal microscopy, RCM) позволяет неинвазивно исследовать кожу на глубину до сосочкового слоя дермы с 30-кратным увеличением.
Оптическая когерентная томография (optical coherence tomography, OCT) представляет собой неинвазивный метод визуализации с использованием инфракрасного света. OCT дает возможность увидеть структуры диаметром 3–15 мкм на глубине до 1,5 мм, а также создавать двух- и трехмерные изображения.
Несмотря на обилие диагностических методов, основная проблема диагностики меланомы заключается в том, что далеко не все пациенты с признаками этого заболевания вовремя попадают на обследование к врачу (табл. 3).
Как видно из таблицы, составленной специалистами Хорватского фонда медицинского страхования (Croatian Health Insurance Fund, CHIF), время ожидания приема может достигать нескольких месяцев [26]. Ясно, что подобную диагностику необходимо делать более быстрой и рутинной, поскольку раннее выявление патологически измененных меланоцитарных невусов сможет предотвратить появление множества запущенных случаев рака кожи.
Проблема длительного времени ожидания приема во многом имеет экономический характер: диагностика в дерматоонкологии на основе осмотра и дерматоскопии является уделом узких специалистов, подготовка которых занимает длительное время. Один из разумных способов уменьшить время ожидания приема в дерматоскопии — доверить диагностику менее квалифицированным специалистам, вооруженным при этом современными методами цифровой визуализации поверхности кожи и имеющим доступ к возможностям искусственного интеллекта.
Учитывая важность ранней диагностики меланомы, серьезность и высокую летальность этого заболевания, в последние десятилетия было разработано множество цифровых систем для дерматологов. Одним из примеров является программно-аппаратный комплекс FotoFinder ATBM bodystudio (FotoFinder, Германия).
Для успешной диагностики меланомы с использованием визуальных методов необходимо решить три простых, на первый взгляд, задачи:
Решать эти задачи эффективно можно только при наличии инструмента, который «помнит» каждое новообразование, умеет анализировать его видимые изменения и находить признаки малигнизации. ATBM bodystudio состоит из нескольких блоков, которые позволяют выполнить эти задачи.
Автоматическое картирование поверхности тела (Automated Total Body Mapping, ATBM)
Под управлением компьютера осуществляется съемка всей поверхности тела пациента с использованием цифрового зеркального фотоаппарата. Система создает 20 стандартных снимков разных участков тела в строго определен- ной последовательности, при этом врач (или медицинская сестра) руководит пациентом, указывая ему, какие позы следует принять (рис. 3, 4). На готовых фотографиях можно отметить все подозрительные новообразования, после чего перейти к режиму дерматоскопии. Макроснимок и последующие дерматоскопические микроснимки оказываются связанными, что важно при анализе поверхности тела с большим количеством новообразований.
Рис. 3. Работа системы автоматического картирования поверхности тела (ATBM) — внизу виден лазерный луч, проецирующий оптимальную позицию для пациента
Автоматический режим съемки и строго повторяемые позиции пациента позволяют решить основную проблему визуализации: компьютерная система «помнит» каждый миллиметр поверхности тела данного пациента и каждое новообразование. Встроенный модуль сканирования изображений Bodyscan (по сути, искусственный интеллект) автоматически сравнивает снимки, сделанные во время разных визитов, и указывает исследователю на все новообразования, которые появились с момента предыдущего посещения, а также на те опухоли, вид которых значительно изменился.
Такое исследование называется тотальным картированием тела. Оно позволяет осуществлять раннюю диагностику меланомы у пациентов, имеющих на теле десятки и сотни невусов — в ситуации, когда ни они сами, ни их лечащий врач не в состоянии отследить появление новых поражений.
Цифровой видеодерматоскоп medicam 1000
Этот модуль системы ATBM bodystudio позволяет получать высококачественные микрофотографии новообразований с использованием всех известных методов дерматоскопии и увеличением до 140 раз. Это устройство, как и любой дерматоскоп, дает возможность рассмотреть поверхность кожи в мельчайших деталях, что несет в себе массу ценной информации.
Помимо этого, medicam 1000, являясь частью всего диагностического комплекса, позволяет прицельно наблюдать за каждым новообразованием, точно зная место его локализации и отслеживая в динамике малейшие изменения. Другими словами, medicam 1000 помогает врачу определить визуальные признаки злокачественного новообразования и оценить его эволюцию во времени, что само по себе является важным диагностическим признаком.
В рамках данной статьи еще более важно отметить то, что medicam 1000 создает снимки, которые могут анализироваться искусственным интеллектом на предмет наличия признаков злокачественного новообразования.
Основные преимущества FotoFinder ATBM bodystudio
Рис. 4. Пример фотогида для выполнения снимков
FOTOFINDER ATBM BODYSTUDIO:
MOLEANALYZER PRO
Программа Moleanalyzer pro разработана на кафедре дерматологии Тюбингенского университета (Германия). Она представляет собой систему для удобной оценки каждого новообразования во время дерматологического осмотра, а также интерфейс для использования искусственного интеллекта в целях анализа изображений и постановки предварительного диагноза.
Возможности Moleanalyzer pro
ИИ программы Moleanalyzer pro «обучен» на более чем 100000 дерматоскопических снимков, включая 75000 гистологически доказанных кожных патологий. В настоящее время это один из наиболее эффективных алгоритмов адаптивной оценки изображений. При определении различий между доброкачественными невусами и злокачественной меланомой чувствительность искусственного интеллекта Moleanalyzer pro достигает 96,7%, специфичность — 85,4% [29].
Помимо собственной оценки новообразования и оценки, сформированной ИИ, дерматолог может запрашивать мнение своих коллег, используя онлайн-сервис FotoFinder Hub. Cервис Second Opinion Service позволяет привлекать для удаленной консультации ведущих экспертов-дерматологов с большим опытом работы. FotoFinder помогает создавать подробные отчеты с данными диагностики, такие отчеты можно транслировать своим более опытным коллегам по почте. Интересно, что сам специалист, работающий на FotoFinder, не обязательно должен обладать большим опытом в области дерматоскопии, его главная задача — качественно произвести захват изображения. Подключаемые ресурсы ИИ и Second Opinion помогут быстро принять правильное решение.
Искусственный интеллект уже успел активно проявить себя в «полевых условиях» медицины. Так, в 2016 г. австралийский профессор Клифф Розендаль опубликовал в журнале International Journal of Dermatology отчет, описывающий визуализацию самой маленькой меланомы в мире — она была выявлена с помощью FotoFinder ATBM bodystudio [30]. Дерматоскопический диаметр новообразования составил 0,9 мм, гистологический — 0,6 мм (рис. 5).
Еще одно очень интересное исследование было опубликовано 28 мая 2018 г. в журнале Annals of Oncology.
Рис. 5. Самая маленькая меланома (d = 0,9/0,6 мм), зафиксированная в мире по состоянию на 2016 г. (выявлена при помощи FotoFinder ATBM bodystudio)
В нем оценивалась эффективность сверточной нейронной сети (СНН) по обнаружению злокачественной меланомы в сравнении с 58 опытными дерматологами со всего мира [31].
Сверточная нейронная сеть (convolutional neuralnetwork) — это специальная архитектура искусственных нейронных сетей, нацеленная на эффективное распознавание изображений. Она использует некоторые особенности зрительной коры [32], в которой были открыты так называемые простые клетки, реагирующие на прямые линии под разными углами, и сложные клетки, реакция которых связана с активацией определенного набора простых клеток. Общий принцип работы СНН напоминает принцип работы детского мозга.
В вышеназванной работе исследователи из Германии, США и Франции обучили нейронную сеть выявлению рака кожи, показав ей более 100 000 изображений злокачественных меланом и доброкачественных родинок (невусов). Использовались только дерматоскопии с 10-кратным увеличением. Специалисты отметили, что с каждым «увиденным» изображением СНН улучшала свои способности по дифференциальной диагностике доброкачественных и злокачественных новообразований кожи.
По завершении обучения возможности ИИ были проверены. Для этого создали 2 тестовых набора изображений — один для СНН и один для реальных врачей. Набор для нейросети включал в себя 300 различных по сложности дерматоскопий (но не менее 100 очень сложных), которые ранее не использовались для обучения СНН и не были ей знакомы. Набор для живых врачей включал в себя 100 снимков, но все они были очень сложными. Такое различие в числе и качестве снимков было сделано специально, поскольку исследователи хотели оценить не только эффективность, но и скорость работы нейронной сети.
Для участия в эксперименте были приглашены дерматологи со всего мира — свое согласие дали 58 человек. 17 (29%) из них имели менее 2 лет опыта в чтении дерматоскопий, 11 (19%) — от 2 до 5 лет, а 30 (52%) являлись экспертами с более чем 5-летним стажем. Сначала врачей попросили дифференцировать злокачественные и доброкачественные новообразования только по дерматоскопии (уровень I) и принять решение о дальнейшей тактике — операция, динамическое наблюдение или отсутствие необходимости в каких-либо действиях. Спустя 4 нед им была предоставлены клиническая информация о пациенте (пол, возраст, локализация поражения) и детальные снимки новообразований (уровень II) — необходимо было снова определить дальнейшую тактику.
На уровне I дерматологи правильно идентифицировали в среднем 86,6% злокачественных меланом и 71,3% доброкачественных невусов. На уровне II врачи улучшили свои результаты, правильно указав на 88,9% меланом и 75,7% невусов. Что касается нейрон- ной сети, то она использовала только уровень I — пока- затель верных диагнозов в данном случае составил 95%. Таким образом, нейронная сеть продемонстрировала более высокую эффективность по сравнению с 58 врачами-дерматологами.
ВЫ ГОТОВЫ К БУДУЩЕМУ?
Применение искусственного интеллекта в дерматологии и общей медицине — это не фантастика из далекого будущего, а часть современной реальности. Врачи, которые первыми воспользуются новыми возможностями, выведут свои диагностические навыки на абсолютно новый уровень и значительно повысят престиж в глазах пациентов. Когда-то это произошло с аппаратами ультразвуковой диагностики, затем настал черед популярности компьютерной томографии.
В дерматологии такими технологиями можно назвать автоматическое картирование поверхности тела (ATBM) и интеллектуальный скрининг меланомы (Moleanalyzer pro).
Они используются в FotoFinder ATBM bodystudio — универсальном решении для центров эстетической медицины, позволяющем быстро и эффективно оценивать состояние кожи и протоколировать результаты процедур на лице и теле.
ЛИТЕРАТУРА