Авторы статьи: Yirui Zhu, Hanhe Zhao, Xiaodan Huang, Lin Lin, Yanan Huo, Zhenwei Qin, Jiale Lu & Xiuming Jin.
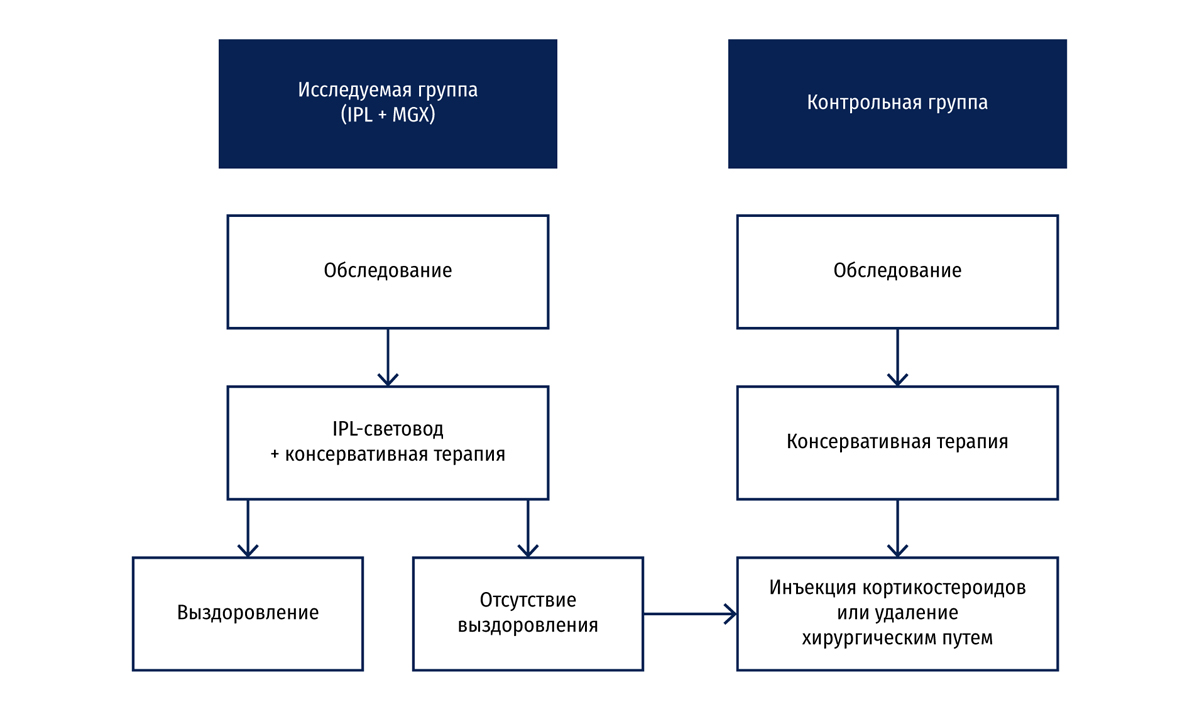
Мы оценивали эффективность интенсивного импульсного света (IPL), поступающего через световод небольшого диаметра, в сочетании с массажем мейбомиевых желез (MGX) в лечении халязиона. В ходе исследования 95 глаз, на которых присутствовал халязион, получали лечение IPL с последующим массажем мейбомиевых желез — исследуемая группа; а на других 95 глазах было проведено вскрытие капсулы халязиона с выскабливанием содержимого — контрольная группа.
До начала исследования (IPL-терапии или вскрытия капсулы), а также через 1 месяц после последнего сеанса лечения собирали и анализировали данные относительно локализации и размера халязиона, гиперемии, случаев рецидива халязиона, а также результаты полного офтальмологического обследования. Общее количество очагов халязиона в исследуемой группе значительно сократилось после последнего сеанса курса, степень выздоровления составляла 70,5 %, что сопоставимо с результатами хирургического вмешательства. В исследуемой группе наблюдалось более заметное сокращение частоты рецидива халязиона, чем в контрольной.
Кроме того, комбинированная IPL + MGX терапия показывала более выраженные улучшения показателей неинвазивного времени разрыва слезной пленки (NIBUT), а также качества секрета мейбомиевых желез по сравнению с исходными значениями и теми же показателями в контрольной группе. Применение IPL + MGX показало свою эффективность в сокращении размера халязиона и частоты его рецидива, а также в улучшении функции мейбомиевых желез. Метод может считаться приоритетным выбором для лечения первичного или повторного халязиона (рецидива), сопровождающихся воспалением.
Халязион — это острое липогранулематозное воспалительное заболевание, вызванное, как правило, закупоркой протоков мейбомиевых желез, и часто приобретающее хроническую форму [1]. К этому распространенному заболеванию век могут быть склонны пациенты всех возрастов, в том числе дети [2]. Проведенные ранее исследования показали, что пациенты, страдающие от дисфункции мейбомиевых желез (ДМЖ) и хронического блефарокератоконъюнктивита, чаще подвержены халязиону и частому повторному его появлению. Это связано с тем, что такие пациенты длительное время страдают от ослабленной функции мейбомиевых желез, морфологические характеристики которых в итоге меняются [3].
В 25–50 % случаев халязион проходит сам по себе, но процесс выздоровления можно сократить до 1–3 месяцев, начав применять терапию как можно раньше [4]. Существует множество терапевтических методов, в том числе гигиеническая обработка век с применением теплых компрессов, использование офтальмологических мазей с антибиотиками, инъекции кортикостероидов, вскрытие капсулы с выскабливанием содержимого или полное удаление халязиона [5].
Полное удаление и вскрытие с выскабливанием считаются простыми и эффективными методами, однако они могут причинять дискомфорт. Первичный или повторный халязион могут влиять на эстетический вид века, вызывать воспаление, сопровождающееся раздражением глаз, и, возможно, вызывать нарушение зрения за счет механического птоза и роговичного астигматизма [6]. Пациенты, страдающие повторяющимся или не поддающимся терапии халязионом, имеют повышенный риск депрессии, тревожности, что ухудшает качество их жизни.

Optima IPL – аппарат для лечения болезни сухого глаза и фототерапии периорбитальной зоны, созданный лидером в области IPL-технологий – компанией Lumenis. Предназначен для эффективного восстановления функций мейбомиевых желез за счет воздействия на них высокоинтенсивным импульсным светом, также применяется для лечения более 20 различных показаний в дерматологии.
В нашем предыдущем исследовании мы сообщали о высоком уровне появления повторного и трудно поддающегося лечению халязиона после терапии, включая терапию консервативными методами и вскрытие с выскабливанием [7]. Мы выяснили, что сочетание IPL-терапии с массажем мейбомиевых желез обладает низким риском и является эффективной опцией, снижающей вероятность рецидива халязиона после хирургического удаления за счет улучшения функции мейбомиевых желез.
С связи с этим мы сосредоточились на функциональном и анатомическом восстановлении мейбомиевых желез при помощи IPL, а не только на традиционной терапии, такой как, например, вскрытие с выскабливанием. Кроме того, новый неинвазивный метод играет важную роль как в лечении халязиона, так и в улучшении функции мейбомиевых желез.
Интенсивный импульсный свет (IPL) широко применяется в эстетической косметологии и в качестве метода выбора при лечении телеангиэктазии и розацеа, доброкачественных кавернозных гемангиом, деформации вен и коррекции пигментных дисхромий [8, 9]. Улучшение состояния глазной поверхности наблюдалось у пациентов, которые получали IPL-терапию для лечения розацеа [10]. Офтальмологи продемонстрировали эффективность и безопасность IPL и массажа мейбомиевых желез в отношении симптомов сухого глаза и лечения дисфункции мейбомиевых желез [10–12].
В недавних исследованиях было обнаружено, что IPL-воздействие через цилиндрический световод диаметром 6 мм на верхнее веко улучшает симптомы сухого глаза [13]. Данное исследование предполагает, что цилиндрический световод безопасен и эффективен для пациентов с симптомами сухого глаза и видимыми признаками дисфункции мейбомиевых желез. В предыдущем исследовании мы анализировали различие в частоте возникновения рециди- вов халязиона между методом вскрытия с выскабливанием и IPL + MGX терапией и без IPL + MGX терапии [7]. Его результаты показали, что после хирургического вмешательства у пациентов, дополнительно прошедших IPL + MGX лечение, наблюдалось существенное улучшение функции мейбомиевых желез и сокращение частоты повторения халязиона.
IPL разогревает кожу до 50 °C, размягчая секрет, и позволяет телеангиэктазиям поглощать больше энергии для закрытия патологически измененных сосудов [14, 15]. Это вызвало интерес к IPL как потенциальной опции терапии халязиона. В настоящий момент имеется немного исследований, описывающих результаты лечения халязиона и частоту его рецидива после IPL-терапии с использованием цилиндрического световода. Arita и соавторы сообщали об эффективности и безопасности процедуры IPL на щеках и веках с последующим массажем мейбомиевых желез при лечении устойчивого к лечению множественного и рецидивирующего халязиона без хирургического иссечения или выскабливания [16].
В настоящем исследовании оценивались эффективность и безопасность новой опции лечения первичного и повторного халязиона при помощи IPL с использованием цилиндрического световода с последующим массажем мейбомиевых желез.
Это контролируемое, проспективное, открытое клиническое экспериментальное исследование. Оно был согласовано Экспертным советом больницы и внесено в Реестр клинических испытаний (NCT05512572) 23.08.2022. Исследование проводилось с сентября 2021 по март 2022 года в офтальмологической клинике второго аффилированного госпиталя Чжэцзянского университета. Протокол исследования соответствовал принципам Хельсинкской декларации. Информированное согласие было получено от всех пациентов до его начала.
Участниками исследования стали пациенты офтальмологической клиники, соответствующие следующим критериям:
1) возраст не менее 18 лет, без гендерных ограничений;
2) пациенты с халязионом в фазе воспаления (определяется при обследовании щелевой лампой в зависимости от того, насколько содержимое желез распространилось на тарзальную пластинку и окружающие мягкие ткани века, вызывая острую воспалительную реакцию, сопровождающуюся болью и эритемой [17]) с симптомами, не поддающимися консервативной терапии, в том числе лечению офтальмологическими мазями с антибиотиком и теплыми компрессами на протяжении 1 недели;
3) пациенты с фоточувствительными типами (I–IV) кожи по Фицпатрику [18], не имевшие рака кожи или иных состояний, при которых IPL-терапия противопоказана;
4) пациенты, выбравшие IPL-MGX терапию (исследуемая группа).
Пациенты, схожие с указанными выше по возрасту, полу и диагнозу, имевшие халязион, не поддающийся лечению мазями с антибиотиком и теплыми компрессами, и прошедшие терапию путем вскрытия капсулы с выскабливанием содержимого, но без последующего IPL + MGX, составили контрольную группу исследования.
Критериями исключения были:
1) любое заболевание глаз или хирургическое вмешательство, в том числе глазная инфекция, аллергия, внутриглазное воспаление, травма в предшествующие исследованию 6 месяцев;
2) любые заболевания век;
3) любые системные состояния, которые могут вызывать сухость глаза;
4) любые кожные заболевания или пигментные новообразования в области лечения;
5) беременность или лактация;
6) любые другие состояния, способные повлиять на глазную поверхность и сделать пациента не соответствующим критериям включения в исследование.
Каждый участник исследуемой группы проходил курс IPL + MGX терапии с трехнедельным интервалом между сеансами. Продолжительность курса зависела от динамики выздоровления. IPL прекращали, когда размер халязиона сокращался на 80–100 %. Минимальное (80 %) уменьшение размера халязиона без повторного появления считалось полным выздоровлением. После IPL-терапии пациенты продолжали использовать мази с антибиотиком и/или теплые компрессы. Каждому пациенту контрольной группы, который не реагировал на консервативную терапию, проводили вскрытие капсулы халязиона с выскабливанием, но не добавляли IPL + MGX.
Клиническое обследование всех пациентов проводили до лечения и через 1 месяц после последнего сеанса курса. Все пациенты продолжали применять теплые компрессы трижды в день, глазные капли Левофлоксацин (Santen) четыре раза в день, глазные мази Тобрамицин и Дексаметазон (Alcon Laboratories) дважды в день на протяжении всего срока исследования.
Никому из пациентов не разрешали начинать поверхностное или системное применение других средств от халязиона или дисфункции мейбомиевых желез на протяжении курса лечения. Частоту рецидива халязиона оценивали через 6 месяцев после терапии (Рис. 1).
В данном исследовании применяли IPL-систему с технологией оптимального импульса (M22, Lumenis) с ксеноновой лампой со спектром излучения в диапазоне 515–1200 нм и отсекающим фильтром 590 нм. Перед первой IPL-процедурой определяли тип кожи по Фицпатрику и выбирали подходящие параметры (12–14 Дж/см2). После обезжиривающей обработки кожи лица и век наносили поверхностную анестезию (крем, содержащий лидокаин, Ziguang Pharmaceutical Co., Ltd, Beijing Китай). Через 30 минут крем удаляли, затем в глаза закапывали капли Пропаракаин. Роговицу и склеру глаз закрывали специальным защитным щитком, который помещали в конъюнктивальный мешок (Suzhou Mingren Medical Equipment Co. Ltd., Suzhou, China). Затем на верхнее и нижнее веки наносили светопроводящий гель.
На первом этапе на верхнем, нижнем веках и в периорбитальной области производили 12 вспышек, а затем еще 6–10 вспышек вокруг каждого халязиона при помощи световода (цилиндрический световод диаметром 6 мм, М22, Lumenis). При этом от границы века отступали на 2–3 мм, стараясь не повредить ресницы (Рис. 2 и Рис. 3).
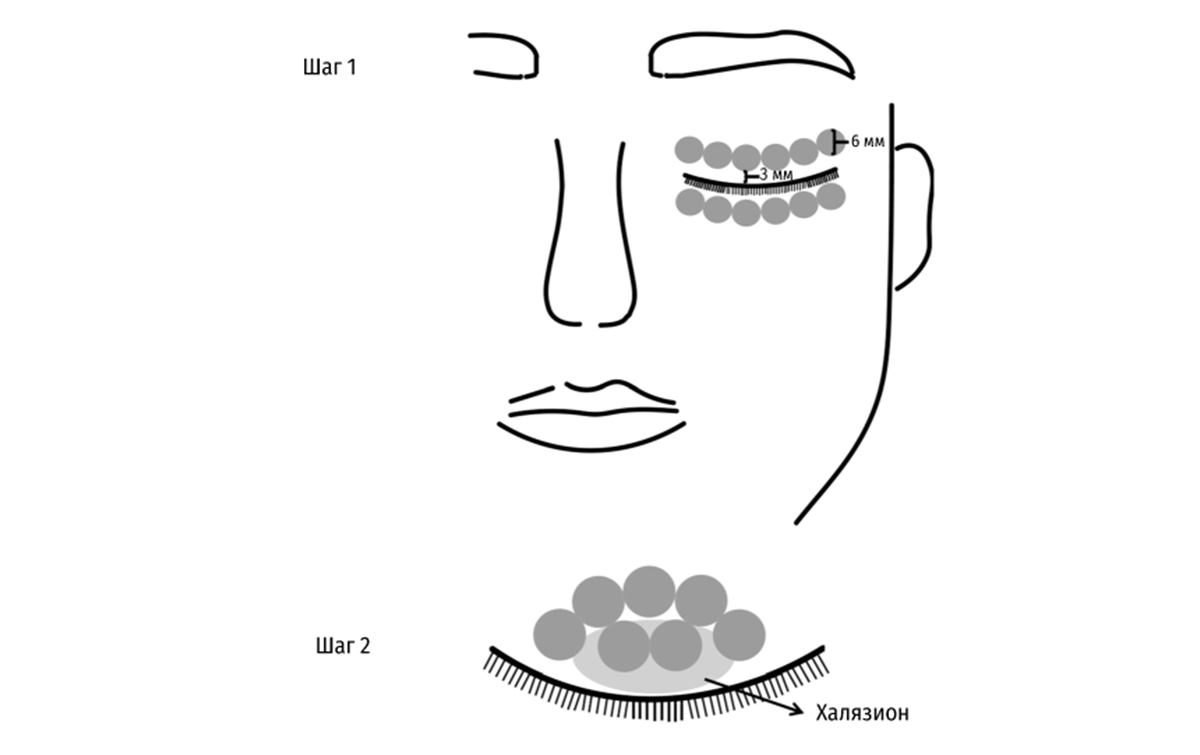
Рисунок 2. Шаг 1 – область лечения IPL световодом включала 6 пересекающихся участков в периорбитальной зоне (6 мм в диаметре каждый) на каждом веке. Шаг 2 – еще 6–10 IPL-вспышек производили вокруг каждого халязиона с небольшим перекрытием
На втором этапе IPL-вспышки повторяли в том же порядке. После окончания IPL-процедуры удаляли остатки геля, извлекали защитный щиток, и проводили массаж мейбомиевых желез с использованием щипцов (Suzhou Mingren Medical Equipment Co. Ltd., Suzhou, Китай). В конъюнктивальный мешок закапывали капли Левофлоксацин. Другой глаз, на котором халязион отсутствовал, не подвергали ни IPL-терапии, ни массажу.
Один и тот же офтальмолог амбулаторно проводил все IPL-процедуры и все хирургические манипуляции. Сеансы проводили с трехнедельным интервалом, согласно упомянутому ранее протоколу, до тех пор, пока халязион не вылечивали. Халязион фотографировали до IPL-терапии или до операции, а затем через месяц после окончания терапии – на контрольном визите.
Халязион считали вылеченным, если его размер уменьшался на 80–100 % и рецидива не наблюдалось в последующие 6 месяцев, исходя из клинического обследования и цифровых фотографий. Пациентам, у которых наблюдалось минимальное уменьшение халязиона после IPL-процедур или заболевание повторялось после трех сеансов, предлагали инъекции кортикостероидов или хирургическое вскрытие с выскабливанием.
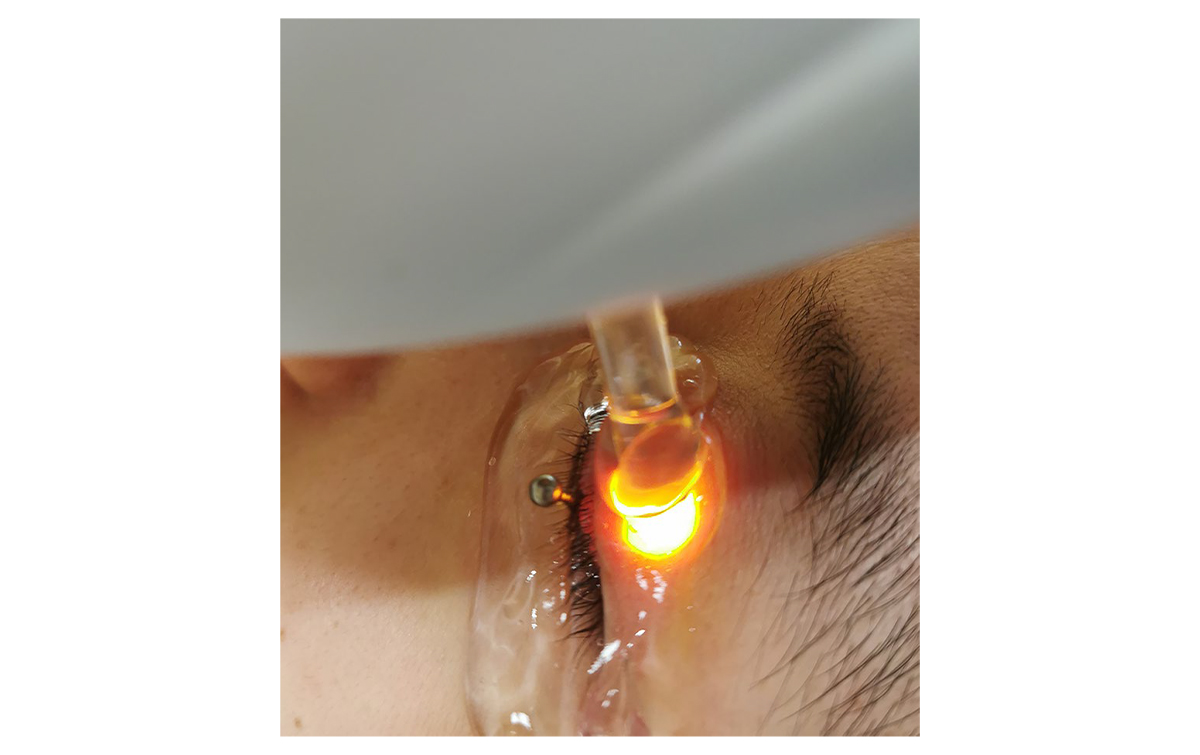
Рисунок 3. Защита роговицы и склеры защитным щитком, помещенным в конъюнктивальный мешок, во время IPL-процедуры
Перед началом лечения изучали карточку пациента, в которой были указаны возраст, пол, время, прошедшее с момента появления халязиона до начала лечения, количество очагов, количество вскрытий с выскабливанием в прошлом, патология краев века, связанная с расширенными сосудами. Диаметр (мм) каждого халязиона измеряли линейкой, сумму длин каждого халязиона по горизонтали принимали за общий (суммарный) размер. Васкуляризацию краев века оценивали как 0 = отсутствует; 1 = легкая степень; 2 = умеренная; 3 = выраженное утолщение [19].
Для оценки эффективности лечения до его начала и через месяц после последнего сеанса IPL+MGX измеряли следующие параметры: характеристики халязиона, включая его локализацию и размер, гиперемию, количество секрета и его состояние путем микроскопии через щелевую лампу. Кератограф (Keratograph 5M (Oculus, Wetzlar, Германия)) применяли для измерения неинвазивного времени разрыва слезной пленки (NIBUT), высоты слезного мениска (TMH) и степени гиперемии бульбарной конъюнктивы автоматическим неинвазивным объективным способом, согласно инструкции производителя [20].
Сканирующая система R-scan позволяла проводить автоматическую классификацию гиперемии конъюнктивы. Программа автоматически определяла состояние бульбарной и лимбальной конъюнктивы в то время, когда взгляд пациента был направлен прямо, и подсчитывала бульбарную (назальную, темпоральную и общую) и лимбальную (назальную и темпоральную) степени покраснения по шкале от 0 до 4 с шагом в 0,1 пункта. Методом неинвазивной мейбографии анализировали морфологию мейбомиевых желез.
Результат показывал одну из четырех степеней атрофии мейбомиевых желез: 0 = отсутствует; степень 1 = атрофия менее 1/3 желез; степень 2 = атрофия 1/3 или 2/3 желез; степень 3 = атрофия 2/3 и более желез. Чем выше степень, тем больше область атрофии [21]. Дисфункцию мейбомиевых желез определяли согласно стандартам Международного семинара по дисфункции мейбомиевых желез [22].
Качество выделяемого секрета: 0 — прозрачный, 1 — мутный, 2 — мутный с гранулированными частицами, и 3 — густой, пастообразный. Чем выше был показатель, тем хуже качество секрета. Пять центральных желез анализировали с использованием устройства для исследования мейбомиевых желез (Tear Science Inc.), чтобы измерить их способность к эвакуации секрета [23].
Критериями классификации были: 0 — все железы способны к эвакуации, 1 — 3 или 4 железы, 2 — 1 или 2 железы, и 3 — способные к эвакуации секрета железы отсутствуют.
Все побочные эффекты фиксировали на каждом плановом и внеплановом визитах в ходе исследования. До лечения и через 1 месяц после последнего сеанса проводили обследование на предмет ожога века, покраснения или отека, проверяли остроту зрения, помутнение хрусталика, измеряли внутриглазное давление, а также проводили обследование глазного дна.
Для анализа эффективности в расчет принимали только глаза, которые подвергали лечению. Норма и однородность переменных анализировали при помощи критерия Шапиро-Уилка и теста Левена на равенство дисперсий. Все данные выражались средним значением и стандартным отклонением (среднее значение ± стандартное отклонение).
Критерий Уилкоксона применяли для сравнения размера халязиона, количества хирургических вмешательств, TMH, NIBUT, показателей бульбарной конъюнктивальной гиперемии, состояния секрета, остроты зрения, внутриглазного давления до и после лечения. U-критерий Манна-Уитни применяли для сравнения количественных переменных между исследуемой и контрольной группами. Пол и локализация халязиона, время его появления, частоту рецидива сравнивали при помощи критерия χ2 (критерий Пирсона).
Весь статистический анализ проводили с использованием программы SPSS 26.0 (SPSS, IBM Corporation, Chicago, IL, США). Значение P < 0,05 считалось статистически значимым для двусторонних статистических тестов.
Исследование было одобрено экспертным советом второго аффилированного госпиталя Чжэцзянского университета.
Таблица 1. Характеристики участников исследования в исследуемой и контрольной группах
| Характеристики | Исследуемая группа (IPL-MGX) | Контрольная группа | P значение |
| Количество глаз (пациентов) | 95 (64) | 95 (72) | – |
| Пол | 0,07 | ||
| Мужской | 26 (40,6 %) | 35 (48,6 %) | – |
| Женский | 38 (59,4 %) | 37 (51,4 %) | – |
| Возраст (лет) (±SD; диапазон) | 34,9 ± 9,0 (19–57) | 37,4 ± 10,7 (19–67) | 0,06 |
| Время с момента появления халязиона (нед) | 3,4 ± 1,9 | 3,7 ± 1,8 | 0,23 |
| Локализация | 0,24 | ||
| RUL | 21 (22,1 %) | 17 (17,9 %) | – |
| RLL | 12 (12,6 %) | 20 (21,1 %) | – |
| RUL + RLL | 16 (16,8 %) | 13 (13,7 %) | – |
| LUL | 19 (20 %) | 22 (23,1 %) | – |
| LLL | 13 (13,7 %) | 17 (17,9 %) | – |
| LUL + LLL | 14 (14,8 %) | 6 (6,3 %) | – |
| Количество очагов | 0,16 | ||
| 1 | 38 (40 %) | 45 (47,3 %) | – |
| 2 | 30 (31,6 %) | 25 (26,3 %) | – |
| 3 | 10 (10,5 %) | 16 (16,9 %) | – |
| 4 | 8 (8,4 %) | 6 (6,3 %) | – |
| 5 | 4 (4,2 %) | 3(3,2 %) | – |
| 6 | 5 (5,3 %) | 0 (0 %) | – |
| Появление халязиона | 0,13 | ||
| Новый | 14 (14,7 %) | 28 (29,5 %) | – |
| Повторный | 81 (85,3 %) | 67 (70,5 %) | – |
| Суммарный размер (±SD; см) | 1,0 ± 0,8 | 0,9 ± 0,6 | 0,6 |
| Количество хирургических удалений в прошлом | 0,8 ± 0,9 | 0,7 ± 0,8 | 0,47 |
| Утолщение края век в связи с расширением сосудов | 35 (36,8 %) | 31 (32,6 %) | 0,44 |
RUL — правое верхнее веко; RLL — правое нижнее веко; LUL — левое верхнее веко; LLL — левое нижнее веко; SD — стандартное отклонение. *P значения < 0,05 считались статистически значимыми. Пол и локализация халязиона, частоту появления новых и повторных очагов сравнивали с применением критерия X2. Критерий Уилкоксона применяли для сравнения размера очагов, количества операций.
95 глаз (64 пациента) составляли исследуемую группу, 95 глаз (72 пациента) — контрольную группу. Большинство пациентов обратились за лечением в связи с повторным случаем халязиона. 85,3 % случаев в исследуемой группе и 70,5 % в контрольной группе имели первичный или вторичный эпизод халязиона. В исследуемой группе средний период времени между появлением халязиона и началом лечения составлял 3,4 недели, в контрольной группе — 3,7 недель.
Случаи утолщения краев века в связи с расширением сосудов составляли 36,8 % в исследуемой группе и 32,6 % в контрольной. Средний суммарный размер халязиона в исследуемой группе составлял 1,0 ± 0,8 см, с иссечениями в прошлом 0,8 ± 0,9 (Таблица 1).
Большинство пациентов (66 глаз, 69,5 %) проходили по 4 сеанса IPL + MGX терапии, другие — по 3 сеанса (16 глаз, 16,8 %), 5 сеансов (11 глаз; 11,6 %) или 6 сеансов (2 глаза; 2,1 %; Таблица 2). Среднее количество сеансов IPL + MGX составляло 4,0 ± 0,61 (диапазон от 3 до 6). Среднее количество операций по вскрытию халязиона с выскабливанием в контрольной группе составляло 2,1 ± 0,7 (диапазон от 1 до 4). Суммарный размер очагов халязиона в исследуемой группе значительно сокращался с 1,0 ± 0,8 до 0,4 ± 0,6 см после последнего сеанса, тогда как в контрольной группе он уменьшался с 0,9 ± 0,6 до 0,2 ± 0,5 см.
После последнего сеанса терапии общий размер очагов халязиона в исследуемой и контрольной группах показывал существенное уменьшение по сравнению с исходными показателями (P < 0,001). Кроме того, выздоровление наблюдалось у 67 глаз (70,5 %) в исследуемой группе и у 73 глаз (76,8 %) в контрольной группе (P = 0,323).
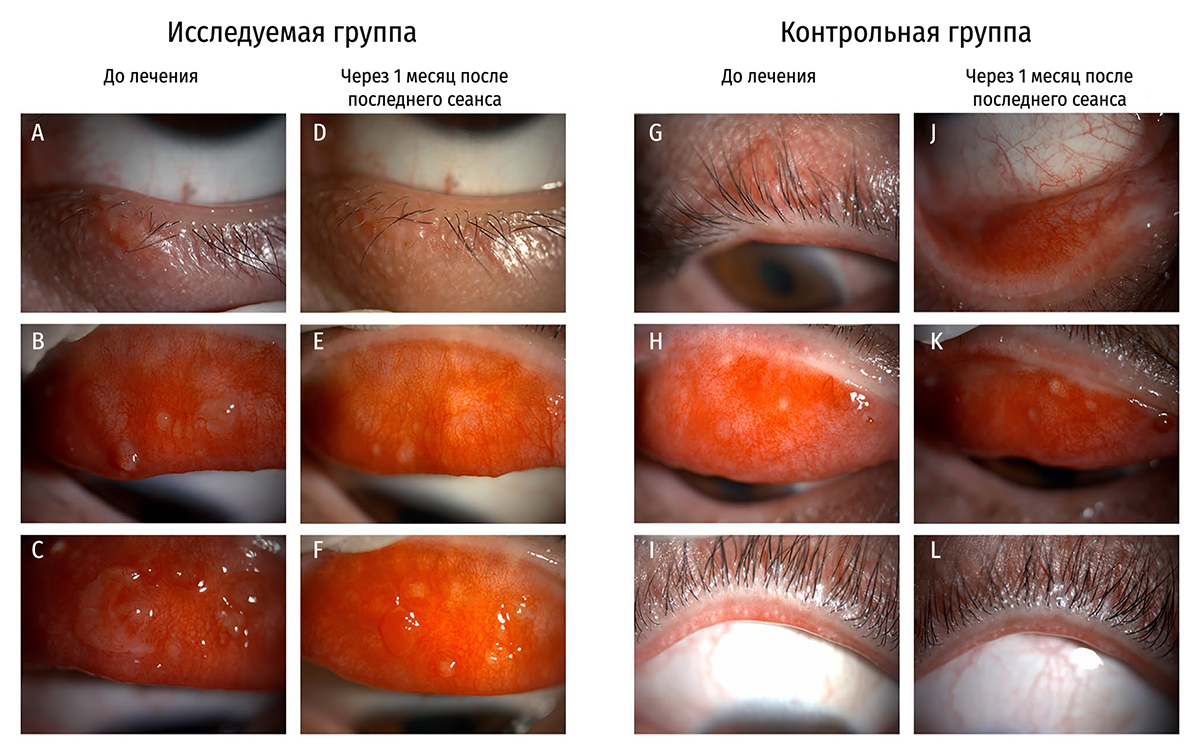
Рисунок 4. (A-F) Кейс 25 в исследуемой группе показывал ощутимое улучшение в размере халязиона от исходного значения к контрольному осмотру через месяц после последнего сеанса.
(G-L) Повторный эпизод халязиона у пациента контрольной группы на нижнем веке и отсутствие видимого улучшения утолщения края века в связи с расширением сосудов
Пациентам с повторными случаями халязиона (14 глаз, 14,7 %) в исследуемой группе, которые не реагировали на два курса лечения IPL + MGX, были рекомендованы инъекции кортикостероидов или вскрытие с выскабливанием. Самым большим преимуществом IPL + MGX было значительное сокращение количества повторных случаев халязиона по сравнению с контрольной группой (14 глаз, 14,7 % против 36 глаз, 37,9 %; P < 0,001).
До лечения не было существенной разницы в показателях NIBUT, конъюнктивальной гиперемии или параметрах секрета между группами, кроме TMH. Высота слезного мениска в контрольной группе изначально была ниже, чем в исследуемой (P = 0,045). В исследуемой среднее значение TMH более заметно возрастало через месяц после последнего сеанса по сравнению с контрольной группой (0,18 ± 0,05 против 0,15 ± 0,04; P = 0,003). Однако показатель TMH до и после лечения внутри групп существенно не различался. NIBUT значительно увеличилось с 5,6 ± 2,3 секунд до 8,1 ± 3,0 секунд через месяц после окончания курса IPL + MGX (P < 0,001).
После терапии в исследуемой группе наблюдалось статистически значимое увеличение NIBUT и статистически значимое уменьшение показателя качества секрета (чем меньше показатель, тем выше качество) по сравнению с контрольной. После последней процедуры в исследуемой группе были значимые улучшения в NIBUT, качества секрета и атрофии мейбомиевых желез (Рис. 4, 5, 6). Однако только бульбарная конъюнктивальная гиперемия статистически значимо уменьшалась в контрольной группе (P = 0,011; Рис. 6, Таблица 3).
Из 95 участников, получавших IPL-терапию, 38 сообщали о легких болевых ощущениях и чувстве жжения во время процедуры, легкое покраснение век наблюдалось непосредственно после IPL-процедуры. Однако никто из этих пациентов не отказался от продолжения исследования из-за дискомфорта. Все 38 участников испытывали облегчение этих симптомов через 5 минут после того, как были наложены холодные компрессы.
Необратимых повреждений кожи век или выпадения ресниц не отмечалось. Острота зрения и внутриглазное давление существенно не менялись после обоих видов терапии (для всех P > 0,05; Таблица 4). Ни у кого из пациентов не было существенных изменений в переднем сегменте, помутнения хрусталика или изменения состояния глазного дна.
Таблица 2. Характеристики исследуемой и контрольной групп через месяц после последнего сеанса и на контрольных визитах
| Характеристики | Исследуемая группа (IPL-MGX) | Контрольная группа | P значение |
| Количество IPL-процедур | |||
| 3 | 16 (16,8 %) | – | – |
| 4 | 66 (69,5 %) | – | – |
| 5 | 11 (11,6 %) | – | – |
| 6 | 2 (2,1 %) | – | – |
| Локализация | 0,25 | ||
| RUL | 14 (21,8 %) | 4 (14,8 %) | – |
| RUL + RLL | 12 (18.8%) | 3 (11,2 %) | – |
| LUL | 9 (14,1 %) | 5 (18,5 %) | – |
| LLL | 6 (9,4 %) | 7 (25,9 %) | – |
| LUL + LLL | 13 (20,3 %) | 1 (3,7%) | – |
| Суммарный размер (±SD; см) | 0,4 ± 0,6 | 0,2 ± 0,5 | < 0,001*** |
| Степень выздоровления | 70,5 % | 76,8 % | 0,323 |
| Среднее кол-во IPL-процедур (±SD) | 4,0 ± 0,61 | – | – |
| Среднее количество хирургических удалений (±SD) | – | 2,1 ± 0,7 | – |
| Рецидив | 14 (14,7 %) | 36 (37,9 %) | < 0,001*** |
| После терапии | |||
| Инъекции кортикостероидов | 11 (78,6 %) | 32 (88,9 %) | – |
| Вскрытие с выскабливанием | 3 (21,4 %) | 4 (11,1 %) | – |
RUL — правое верхнее веко; RLL — правое нижнее веко; LUL — левое верхнее веко; LLL — левое нижнее веко; SD — стандартное отклонение. * P — значения < 0,05 считались статистически значимыми (U-критерий Манна-Уитни).
Это проспективное и контролируемое исследование должно было продемонстрировать, что IPL-терапия, проведенная с помощью цилиндрического световода непосредственно на веки и область халязиона, существенным образом улучшила объективные симптомы и проявления в сравнение с консервативным лечением пациентов с халязионом.
Результаты нашего исследования продемонстрировали, что сочетание IPL-терапии с помощью цилиндрического световода и MGH приводило к сравнимому с оперативным вмешательством уровню разрешения халязиона, уменьшению частоты рецидивов, увеличению времени разрываслезной пленки и улучшению функции мейбомиевых желез.
Предыдущие исследования сообщали, что степень эффективности консервативной терапии распространяется от 25 до 87 % и сильно зависит от того, какой врач назначает и как пациент соблюдает режим лечения [24, 25]. Эффективность составляла 8,7–86,7 % при одной инъекции кортикостероидов. Эффективность второй инъекции составляла 19 % и распространялась от 0 до 53,8 % [26]. Частота рецидива халязиона составляла от 0 до 27,3 % в случае лечения инъекциями кортикостероидов [27, 28]. Ранее мы сообщали о частоте рецидива халязиона 45,6 % [7].
В данном исследовании мы обнаружили, что IPL + MGX терапия приводила к полному выздоровлению или почти полному выздоровлению при первичном и вторичном халязионе в среднем после 4 сеансов в более чем 70 % случаев. То есть IPL + MGX терапия показала схожий с хирургическим вмешательством результат, но меньшую частоту рецидива.
В другом исследовании сообщалось о более высоком показателе эффективности терапии 96,15 % после 1–3 IPL-сеансов в острой воспалительной фазе халязиона, в зависимости от продолжительности заболевания и повторяемости халязиона [29]. Arita и соавторы оценивали эффективность IPL-процедур, проводимых на щеках, верхних и нижних веках, в сочетании с MGX для лечения устойчивого к терапии множественного и повторяющегося халязиона без хирургического удаления или выскабливания. Они полагали, что симптомы, размер халязиона, количества клещей демодекса и аномалии краев век существенно улучшались после IPL + MGX [16].
Сомнение относительно применения IPL в указанном исследовании вызывало то, что на ранней острой воспалительной фазе халязион может лучше реагировать на консервативное лечение или выскабливание. Наше исследование подкрепляет предположение, что IPL, применяемый непосредственно на веке, может быть подходящей альтернативой хирургическому удалению для первичного или повторного халязиона с воспалением [7]. Bei Rong и соавторы применяли IPL-терапию непосредственно на верхнем и нижнем веках у пациентов, которым была диагностирована дисфункция мейбомиевых желез [30]. Способность к эвакуации секрета, время разрыва слезной пленки, показатели окрашивания роговицы флуоресцеином и оценка сухости глаза существенно улучшались у пациентов с дисфункцией мейбомиевых желез.
В нашем исследовании IPL + MGX лечение значительно улучшало NIBUT, степень конъюнктивальной гиперемии, состояние желез в плане, например, активности желез, качества секрета и атрофии через 1 месяц после финального IPL-сеанса. Показатели NIBUT, качества секрета и способности к эвакуации, а также атрофии желез существенно улучшались через 1 месяц после последнего сеанса IPL + MGX по сравнению с показателями до лечения. Атрофия (выпадение мейбомиевых желез), которая считается необратимым следствием хирургического иссечения халязиона, улучшалась после IPL-терапии. Кроме того, TMH, NIBUT и активность желез более существенно улучшались после терапии в исследуемой группе по сравнению с контрольной.
Таблица 3. Разница показателей измерений в исследуемой и контрольной группе на осмотре до и через месяц после последнего сеанса
| До лечения | Через 1 месяц после последнего сеанса курса | P значение | |
| TMH | |||
| Исследуемая группа (IPL-MGX) | 0,17 ± 0,05 | 0,18 ± 0,05 | – |
| Контрольная группа | 0,16 ± 0,04 | 0,15 ± 0,04 | – |
| P значение | 0,045* | 0,003** | – |
| NIBUT | |||
| Исследуемая группа (IPL-MGX) | 5,6 ± 2,3 | 8,1 ± 3,0 | < 0,001### |
| Контрольная группа | 5,5 ± 2,1 | 5,3 ± 2,2 | 0,41 |
| P значение | 0,769 | < 0,001*** | – |
| Конъюнктивальная гиперемия | |||
| Исследуемая группа (IPL-MGX) | 1,26 ± 0,4 | 1,16 ± 0,3 | 0,051 |
| Контрольная группа | 1,29 ± 0,4 | 1,15 ± 0,32 | 0,011# |
| P значение | 0,655 | 0,73 | – |
| Способность мейбомиевых желез к эвакуации секрета | |||
| Исследуемая группа (IPL-MGX) | 1,57 ± 0,66 | 1,02 ± 0,55 | < 0,001### |
| Контрольная группа | 1,53 ± 0,81 | 1,6 ± 0,75 | 0,56 |
| P значение | 0,68 | < 0,001*** | – |
| Качество секрета мейбомиевых желез | |||
| Исследуемая группа (IPL-MGX) | 2,58 ± 0,66 | 2,02 ± 0,55 | < 0,001### |
| Контрольная группа | 2,52 ± 0,81 | 2,72 ± 0,73 | 0,91 |
| P значение | 0,087 | < 0,001*** | – |
| Атрофия мейбомиевых желез | |||
| Исследуемая группа (IPL-MGX) | 2,69 ± 0,97 | 2,32 ± 0,97 | 0,003## |
| Контрольная группа | 2,58 ± 1,02 | 2,83 ± 0,79 | 0,07 |
| P значение | 0,533 | < 0,001*** | – |
IPL часто применяют при процедурах на лице, ограничиваясь областью, прилегающей к веку [31, 32], чтобы обеспечить безопасность лечения, но мы работали IPL непосредственно на веках с использованием окулярных защитных щитков, помещенных в конъюнктивальный мешок. Серьезных побочных эффектов во время исследований не наблюдалось. Около 1/3 пациентов жаловались на незначительное жжение и легкую эритему на веках при IPL + MGX терапии. Это предполагает необходимость подбора более мягких параметров с целью оптимизации лечения.
В некоторых исследованиях, посвященных IPL-терапии, сообщалось о позитивном влиянии IPL на воспаление, в частности, воспаление прекращалось под воздействием IPL через повышающее регулирование противовоспалительных агентов и/или понижающее регулирование провоспалительных агентов [33–35]. Во-вторых, температура кожи при IPL-процедуре может подниматься до почти 70 °С.
В ответ на термическое воздействие происходит раскрытие мейбомиевых желез, размягчение секрета и улучшается распределение липидов мейбомиевых желез по глазной поверхности [36, 37]. Кроме того, демодекс — потенциальный медиатор блефарита, чей экзоскелет содержит пигментные хромофоры, которые поглощают энергию IPL [38]. Уничтожение демодекса уменьшает бактериальную нагрузку, влияющую на хроническое воспаление века [39].
В нашем исследовании мы обнаружили, что IPL + MGX лечение улучшало качество секрета, секреторную функцию и атрофию мейбомиевых желез, тогда как консервативное лечение или удаление халязиона сами по себе не работали. Консервативный метод лечения халязиона предполагал применение теплых компрессов, необходимую гигиеническую обработку век, терапию с применение мазей с антибиотиком. Только в ¼ случаев халязион может пройти самостоятельно в среднем за 6 месяцев [24].
Таблица 4. Сравнение остроты зрения и внутриглазного давления до и через 1 месяц после последнего сеанса
| До лечения | Через 1 месяц после последнего сеанса курса | P значение | |
| Исследуемая группа (IPL-MGX) | |||
| Острота зрения | 0,9 ± 0,2 | 0,9 ± 0,2 | 0,54 |
| Внутриглазное давление (мм рт. ст.) |
13,2 ± 3,9 | 13,5 ± 3,1 | 0,15 |
| Контрольная группа | |||
| Острота зрения | 0,8 ± 0,2 | 0,8 ± 0,2 | 0,39 |
| Внутриглазное давление (мм рт. ст.) |
13,0 ± 3,2 | 12,8 ± 2,9 | 1,0 |
Эффективность стероидных инъекций оценивали в предыдущих исследованиях. Khurana и соавторы сообщали, что внутриочаговое введение кортикостероидов было в равной степени эффективным и для небольших очагов, и для халязиона, расположенного на краю века, и для множественного халязиона [41]. Серьезные осложнения инъекций кортикостероидов, включая депигментацию кожи, окклюзию сосудов глазного дна, кровоизлияния после инъекций или случайное повреждение глазного яблока довольно редки [42–45].
Хирургическое иссечение может быть подходящим методом при крупных или инфицированных очагов халязиона или при отсутствии ответа на консервативное лечение [46]. Однако стойкая дисфункция век и эстетические изменения могут возникать при халязионе, локализованном на краю века, и множественных хирургических иссечениях халязиона.
В целом наши пациенты были удовлетворены IPL-процедурами с применением цилиндрического световода небольшого диаметра. В большинстве случаев они предпочитали повторную IPL-терапию хирургическому вмешательству. Преимущества IPL-терапии включают простоту и возможность неоднократно повторять процедуру; возможность применять ее у пациентов, которые плохо переносят длительную терапию или частые хирургические вмешательства; уменьшение частоты рецидива устойчивого к терапии халязиона; возможность лечения очагов, расположенных вблизи слезной точки, а также применение этого метода как альтернативы хирургии при множественных небольших поражениях и очагах халязиона, локализованных на краю века, с воспалением, когда хирургия может приводить к стойким функциональным или эстетическим дефектам.
Пациенты предпочитают курс IPL-процедур хирургии. IPL может улучшить состояние халязиона за счет закрытия патологически измененных кровеносных сосудов и за счет предотвращения выделения медиаторов воспаления, исходя из результатов настоящего исследования. Мы считаем, что IPL-терапия может быть полезна для лечения таких заболеваний во время острой воспалительной фазы и/или при наличии поверхностных сосудов. Использование IPL также рекомендуется для лечения множественного халязиона и халязиона, локализованного на краю века. Однако для инфицированных очагов, хронического воспаления и крупных очагов лечение путем вскрытия капсулы с выскабливанием содержимого более эффективно.
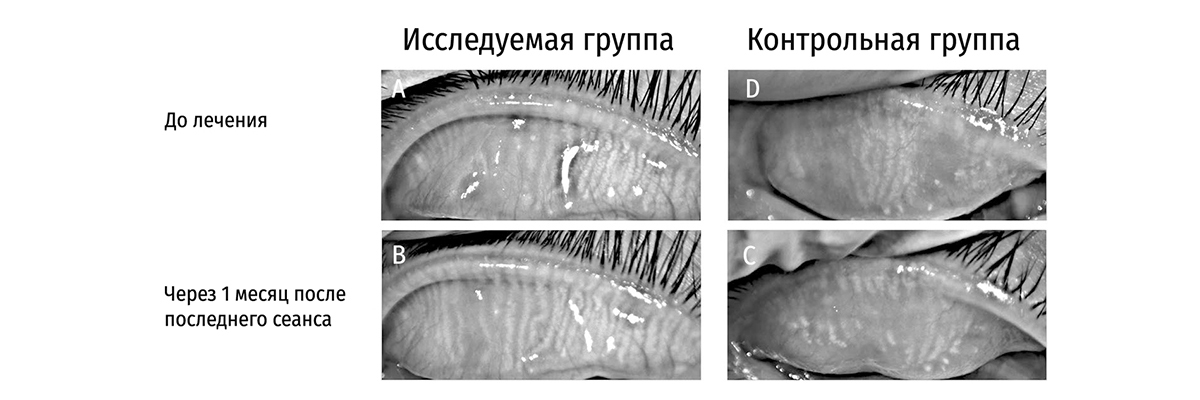
Рисунок 5. Показательные снимки инфракрасной мейбографии верхнего века пациентов исследуемой группы (A, B) и контрольной группы (C, D) от исходных к показателям через 1 месяц после последнего сеанса. В целом у участников контрольной группы наблюдается более обширная атрофия мейбомиевых желез, чем у участников исследуемой группы
Ограничениями настоящего исследования являются потенциальные отклонения из-за различия техник офтальмологов, их предшествующего опыта хирургического лечения и обследования халязиона. Чтобы преодолеть это ограничение для оценки характеристик халязиона и проведения IPL-процедур был выбран единственный офтальмолог. Кроме того, количество IPL + MGX сеансов различалось в зависимости от размера, возраста и длины халязиона, а также степени комфорта пациента при процедуре. Будущие исследования следует проводить с большим объемом выборки пациентов с халязионом, кроме того, предпочтительно проведение большего количества проспективных контролируемых рандомизированных экспериментальных исследований.
В последующих исследованиях рекомендуется более длительное наблюдение, подбор оптимальных параметров IPL-терапии при работе световодом для повышения терапевтической эффективности и изучение механизмов действия IPL на халязион. И наконец, курсовая IPL-терапия с использованием цилиндрического световода малого диаметра с последующим массажем мейбомиевых желез эффективно и безопасно способствует уменьшению размера халязиона и снижению частоты его повторного появления, а также улучшению функции мейбомиевых желез.
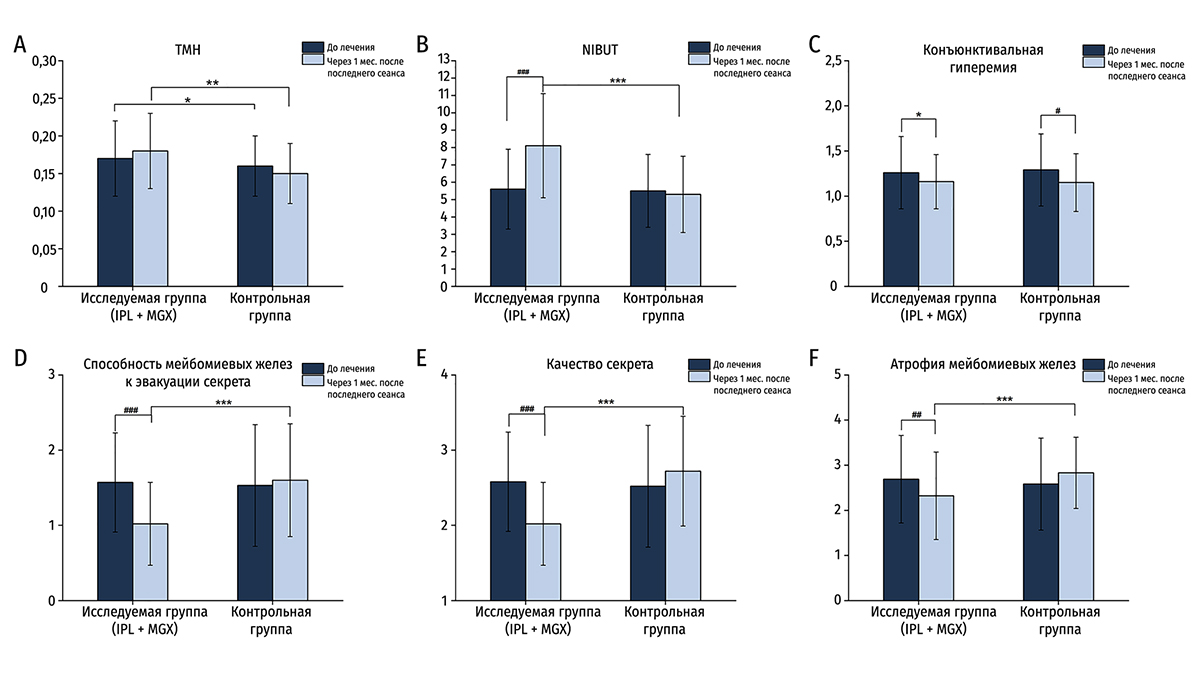
Рисунок 6. (A-F) Изменения TMH, NIBUT, конъюнктивальной гиперемии, качества секрета и способности желез эвакуировать секрет, атрофия мейбомиевых желез до и после последнего сеанса в исследуемой и контрольной группах. (Данные приведены как средние ± SD, исследуемая группа против контрольной, *P < 0,05, ** P < 0,01, *** P < 0,001; до процедуры и через 1 месяц после последнего сеанса, #P < 0,05, ##P < 0,01, ### P < 0,001, критерий Уилкоксона)
Результаты нашего исследования предлагают новую технику лечения рецидивирующего и резистентного к терапии халязиона, связанного с дисфункцией мейбомиевых желез. Необходимо дальнейшее исследование IPL-метода для выяснения, способна ли IPL-терапия, проводимая в клинических условиях с использованием световода малого диаметра, повышать эффективность лечения специфических видов халязиона, плохо поддающихся терапии.
ДОСТУПНОСТЬ ДАННЫХ
Данные, использованные и проанализированные в данном исследовании, доступны для получения от автора, ответственного за переписку, по обоснованному запросу.
Опубликовано онлайн 31 июля 2023 г.
Получено 1 декабря 2022 г.
Принято 24 июля 2023 г.
СПИСОК ЛИТЕРАТУРЫ:
1. Perry, H. D. & Serniuk, R. A. Conservative treatment of chalazia. Ophthalmology 87, 218–221. https://doi.org/10.1016/s0161-6420(80)35250-0 (1980).
2. Chen, L. et al. Prevalence of low serum vitamin a levels in young children with chalazia in southwest china. Am. J. Ophthalmol.157, 1103-1108.e1102. https://doi.org/10.1016/j.ajo.2014.02.020 (2014).
3. Yin, Y. & Gong, L. Te evaluation of meibomian gland function, morphology and related medical history in Asian adult blepharokeratoconjunctivitis patients. Acta Ophthalmol. 95, 634–638. https://doi.org/10.1111/aos.13136 (2017).
4. Dua, H. S. & Nilawar, D. V. Nonsurgical therapy of chalazion. Am. J. Ophthalmol. 94, 424–425. https://doi.org/10.1016/0002-9394(82)90381-6 (1982).
5. Ben Simon, G. J. et al. Intralesional triamcinolone acetonide injection for primary and recurrent chalazia: Is it really efective?. Ophthalmology 112(5), 913–917. https://doi.org/10.1016/j.ophtha.2004.11.037 (2005).
6. Cosar, C. B., Rapuano, C. J., Cohen, E. J. & Laibson, P. R. Chalazion as a cause of decreased vision afer LASIK. Cornea 20, 890–892. https://doi.org/10.1097/00003226-200111000-00024 (2001).
7. Zhu, Y. et al. Efcacy of intense pulsed light in the treatment of recurrent chalaziosis. Front. Med. 9, 839908. https://doi.org/10.3389/fmed.2022.839908 (2022).
8. Raulin, C., Greve, B. & Grema, H. IPL technology: A review. Lasers Surg. Med. 32, 78–87. https://doi.org/10.1002/lsm.10145 (2003).
9. Wat, H., Wu, D. C., Rao, J. & Goldman, M. P. Application of intense pulsed light in the treatment of dermatologic disease: A systematic review. Dermatol. Surg. 40, 359–377. https://doi.org/10.1111/dsu.12424 (2014).
10. Toyos, R., McGill, W. & Briscoe, D. Intense pulsed light treatment for dry eye disease due to meibomian gland dysfunction; a 3-year retrospective study. Photomed. Laser Surg. 33, 41–46. https://doi.org/10.1089/pho.2014.3819 (2015).
11. Dell, S. J., Gaster, R. N., Barbarino, S. C. & Cunningham, D. Prospective evaluation of intense pulsed light and meibomian gland expression efcacy on relieving signs and symptoms of dry eye disease due to meibomian gland dysfunction. Clin. Ophthalmol. 11, 817–827. https://doi.org/10.2147/OPTH.S130706 (2017).
12. Vegunta, S., Patel, D. & Shen, J. F. Combination therapy of intense pulsed light therapy and meibomian gland expression (IPL/MGX) can improve dry eye symptoms and meibomian gland function in patients with refractory dry eye: A retrospective analysis. Cornea 35, 318–322. https://doi.org/10.1097/ico.0000000000000735 (2016).
13. Toyos, R., Toyos, M., Willcox, J., Mulliniks, H. & Hoover, J. Evaluation of the safety and efcacy of intense pulsed light treatment with meibomian gland expression of the upper eyelids for dry eye disease. Photobiomodul. Photomed. Laser Surg. 37, 527–531. https://doi.org/10.1089/photob.2018.4599 (2019).
14. Han, J. Y. et al. Efect of intense pulsed light using acne flter on eyelid margin telangiectasia in moderate-to-severe meibomian gland dysfunction. Lasers Med. Sci. 37, 2185–2192. https://doi.org/10.1007/s10103-021-03482-z (2022).
15. Lee, Y. et al. Investigation of prognostic factors for intense pulsed light treatment with a vascular flter in patients with moderate or severe meibomian gland dysfunction. J. Clin. Med. 11(16), 4724. https://doi.org/10.3390/jcm11164724 (2022).
16. Arita, R. & Fukuoka, S. Terapeutic efcacy and safety of intense pulsed light for refractive multiple recurrent chalazia. J. Clin. Med. 11, 5338 (2022).
17. Korn, B. S. et al. Chapter 10 Classifcation of Eyelid Disorders. In: San Francisco (Ed) Basic and Clinical Science Course Oculofacial Plastic and Orbital Surgery. American Academy of Ophthalmology, UK
18. Fitzpatrick, T. B. Te validity and practicality of sun-reactive skin types I through VI. Arch. Dermatol. 124, 869–871. https://doi.org/10.1001/archderm.124.6.869 (1988).
19. Cheng, A. M., Hwang, J., Dermer, H. & Galor, A. Prevalence of ocular demodicosis in an older population and its association with symptoms and signs of dry eye. Cornea 40, 995–1001. https://doi.org/10.1097/ICO.0000000000002542 (2021).
20. Garcia-Marques, J. V., Martinez-Albert, N., Talens-Estarelles, C., Garcia-Lazaro, S. & Cervino, A. Repeatability of non-invasive keratograph break-up time measurements obtained using oculus keratograph 5 M. Int Ophthalmol 41, 2473–2483. https://doi.org/10.1007/s10792-021-01802-4 (2021).
21. Arita, R., Itoh, K., Inoue, K. & Amano, S. Noncontact infrared meibography to document age-related changes of the meibomian glands in a normal population. Ophthalmology 115, 911–915. https://doi.org/10.1016/j.ophtha.2007.06.031 (2008).
22. Tomlinson, A. et al. Te international workshop on meibomian gland dysfunction: Report of the diagnosis subcommittee. Invest. Ophthalmol. Vis. Sci. 52, 2006–2049. https://doi.org/10.1167/iovs.10-6997f (2011).
23. Pfugfelder, S. C. et al. Evaluation of subjective assessments and objective diagnostic tests for diagnosing tear-flm disorders known to cause ocular irritation. Cornea 17, 38–56. https://doi.org/10.1097/00003226-199801000-00007 (1998).
24. Cottrell, D. G., Bosanquet, R. C. & Fawcett, I. M. Chalazions: Te frequency of spontaneous resolution. Br. Med. J. (Clin. Res. Ed.) 287, 1595. https://doi.org/10.1136/bmj.287.6405.1595 (1983).
25. Bohigian, G. M. Chalazion: A clinical evaluation. Ann Ophthalmol. 11, 1397–1398 (1979).
26. Aycinena, A. R., Achiron, A., Paul, M. & Burgansky-Eliash, Z. Incision and curettage versus steroid injection for the treatment of chalazia: A meta-analysis. Ophthalm. Plast. Reconstr. Surg. 32, 220–224. https://doi.org/10.1097/IOP.0000000000000483 (2016).
27. Khurana, A. K., Ahluwalia, B. K. & Rajan, Ch. Chalazion therapy: intralesional steroids versus incision and curettage. Acta Ophthalmol. 66(3), 352–354. https://doi.org/10.1111/j.1755-3768.1988.tb04609.x (2009).
28. Watson, A. P. & Austin, D. J. Treatment of chalazions with injection of a steroid suspension. Br. J. Ophthalmol. 68, 833–835. https://doi.org/10.1136/bjo.68.11.833 (1984).
29. Caravaca, A., Alió del Barrio, J. L., Martínez Hergueta, M. C. & Amesty, M. A. Intense pulsed light combined with meibomian gland expression for chalazion management. Arch. Soc. Esp. Ofalmol. (Engl. Ed.) 97(9), 490–496. https://doi.org/10.1016/j.ofale.2022.06.008 (2022).
30. Rong, B. et al. Intense pulsed light applied directly on eyelids combined with meibomian gland expression to treat meibomian gland dysfunction. Photomed. Laser Surg. 36, 326–332. https://doi.org/10.1089/pho.2017.4402 (2018).
31. Craig, J. P., Chen, Y. H. & Turnbull, P. R. Prospective trial of intense pulsed light for the treatment of meibomian gland dysfunction. Invest. Ophthalmol. Vis. Sci. 56, 1965–1970. https://doi.org/10.1167/iovs.14-15764 (2015).
32. Xue, A. L., Wang, M. T. M., Ormonde, S. E. & Craig, J. P. Randomised double-masked placebo-controlled trial of the cumulative treatment efcacy profle of intense pulsed light therapy for meibomian gland dysfunction. Ocul. Surf. 18, 286–297. https://doi.org/10.1016/j.jtos.2020.01.003 (2020).
33. Byun, J. Y., Choi, H. Y., Myung, K. B. & Choi, Y. W. Expression of IL-10, TGF-beta(1) and TNF-alpha in cultured keratinocytes (HaCaT Cells) afer IPL treatment or ALA-IPL photodynamic treatment. Ann. Dermatol. 21, 12–17. https://doi.org/10.5021/ad.2009.21.1.12 (2009).
34. Lee, S. Y. et al. A prospective, randomized, placebo-controlled, double-blinded, and split-face clinical study on LED phototherapy for skin rejuvenation: Clinical, proflometric, histologic, ultrastructural, and biochemical evaluations and comparison of three diferent treatment settings. J. Photochem. Photobiol. B Biol. 88(1), 51–67. https://doi.org/10.1016/j.jphotobiol.2007.04.008 (2007).
35. Taylor, M., Porter, R. & Gonzalez, M. Intense pulsed light may improve infammatory acne through TNF-α down-regulation. J. Cosmet. Laser Terapy Of. Publ. Eur. Soc. Laser Dermatol. 16, 96–103. https://doi.org/10.3109/14764172.2013.864198 (2014).
36. Borchman, D. et al. Human meibum lipid conformation and thermodynamic changes with meibomian-gland dysfunction. Invest. Ophthalmol. Vis. Sci. 52, 3805–3817. https://doi.org/10.1167/iovs.10-6514 (2011).
37. Gipson, I. K. et al. Research in dry eye: Report of the Research subcommittee of the international dry eye workshop (2007). Ocular Surf. 5(2), 179–193 (2007).
38. Prieto, V. G., Sadick, N. S., Lloreta, J., Nicholson, J. & Shea, C. R. Efects of intense pulsed light on sun-damaged human skin, routine, and ultrastructural analysis. Lasers Surg. Med. 30, 82–85. https://doi.org/10.1002/lsm.10042 (2002).
39. O’Reilly, N., Menezes, N. & Kavanagh, K. Positive correlation between serum immunoreactivity to Demodex-associated Bacillus proteins and erythematotelangiectatic rosacea. Br. J. Dermatol. 167, 1032–1036. https://doi.org/10.1111/j.1365-2133.2012.11114.x (2012).
40. Ben Simon, G. J., Rosen, N., Rosner, M. & Spierer, A. Intralesional triamcinolone acetonide injection versus incision and curettage for primary chalazia: A prospective, randomized study. Am. J. Ophthalmol. 151, 714–718. https://doi.org/10.1016/j.ajo.2010.10.026) (2011).
41. Prasad, S. & Gupta, A. K. Subconjunctival total excision in the treatment of chronic chalazia. Indian J. Ophthalmol. 40, 103–105 (1992).
42. Hoşal, B. M. & Zilelioğlu, G. Ocular complication of intralesional corticosteroid injection of a chalazion. Eur. J. Ophthalmol. 13, 798–799. https://doi.org/10.1177/1120672103013009-1012 (2003).
43. Mohan, K., Dhir, S. P., Munjal, V. P. & Jain, I. S. Te use of intralesional steroids in the treatment of chalazion. Ann Ophthalmol 18, 158–160 (1986).
44. Procope, J. A. & Kidwell, E. D. Jr. Delayed postoperative hemorrhage complicating chalazion surgery. J. Natl Med. Assoc. 86, 865–866 (1994).
45. Tomas, E. L. & Laborde, R. P. Retinal and choroidal vascular occlusion following intralesional corticosteroid injection of a chalazion. Ophthalmology 93, 405–407. https://doi.org/10.1016/s0161-6420(86)33728-x (1986).
46. Castrén, J. & Stenborg, T. Corticosteroid injection of chalazia. Acta Ophthalmol. 61, 938–942. https://doi.org/10.1111/j.1755-3768.1983.tb01477.x (1983).