Rawaa Almukhtar MD, MPH | Emily Carr MD | Mitchel Goldman MD, FAAD
Cosmetic Laser Dermatology (A West Dermatology Company), San Diego, California, USA
Актуальность исследования. Интенсивный импульсный свет (IPL) — одна из наиболее спорных и широко распространенных технологий, основанных на энергии света, которая была представлена в Сан Диего в 1992 году и получила одобрение FDA в конце 1995 года.
Цели. Целью настоящего обзора было осветить ранние этапы применения IPL и многолетнее развитие технологии.
Материалы и методы. При подготовке настоящего обзора были использованы статьи, размещенные на ресурсе PubMed, а также клинический опыт авторов.
Результаты. Изначально IPL был разработан для лечения телеангиэктазий на ногах. Его способность эффективно лечить сосудистые дисхромии одновременно минимизируя пурпуру, которая является распространенным явлением при использовании импульсных лазеров на красителе, а также отшелушивать поверхностные пигментные пятна и удалять волосы, расширила область применения IPL, позволив применять его для лечения пигментных и сосудистых нарушений и играть значительную роль в фотоомоложении кожи.
Обсуждение. IPL — эффективная и безопасная опция лечения широкого круга дерматологических состояний от пигментных до сосудистых поражений и воспалительных заболеваний кожи.
Ключевые слова: интенсивный импульсный свет, фотоомоложение, пигментные нарушения, сосудистые нарушения.
Концепция интенсивного импульсного света (IPL) была впервые предложена в апреле 1992 года в Сан Диего учеными Goldman, Fitzpatrick и Eckhouse для лечения телеангиэктазий на ногах. Исследования Goldman и соавторов [1, 2], проведенное на венах кроличьих ушей, а затем на венах ног человека, проведенное Goldman и Fitzpatrick, показали, что 585 нм лазер с длительностью импульса 0,45 мс может эффективно проводить термическую коагуляцию кровеносных сосудов диаметром менее 0,4 мм. Однако применение лазера на венах человеческих ног вызывало продолжительно сохранявшуюся пурпуру, а также гипо- и гиперпигментацию.
Чтобы преодолеть эти нежелательные побочные эффекты, Goldman and Fitzpatrick начали разрабатывать устройство, способное проводить термическую коагуляцию сосудов и параллельно защищать эпидермис. Eckhouse, аэрокосмический инженер из Израиля, сконструировал первое IPL-устройство в соответствии с техническими характеристиками, предложенными Goldman и Fitzpatrick. В сентябре 1992 года Goldman и Fitzpatrick начали воздействовать на вены ушей кролика IPL с применением одиночного импульса длительностью 1–15 мс и энергии от 10 до 20 Дж/см2, используя отсекающий фильтр 515 нм.
В ходе исследования производили фотографирование и брали биопсию кожи кроличьих ушей в первый час и через 30 дней после IPL-процедур. Многие дорсальные маргинальные вены ушей исчезали, гистологически многие из них были термокоагулированы, при этом эпидермис сохранялся неповрежденным. Результаты своей работы ученые представили на 6-м ежегодном Конгрессе Американской коллегии флебологии (American College of Phlebology) в Орландо в феврале 1993 года в форме доклада, который назывался «Клиническая и гистологическая оценка сосудистых поражений. Применение импульсных источников света на дорсальных венах ушей кролика» (“Clinical and Histologic Evaluation of the ESC Vascular Lesion, Pulsed Light Source on the Dorsal Marginal Rabbit Ear Vein”.) [3].
Подтверждение концепции Goldman и Fitzpatrick на примере вен кроличьих ушей повлекло за собой первое исследование с участием человека, в котором 7 вен на ногах 4 пациентов с винными пятнами, которое проводили в офисе ученых в г. Энсинитас, Калифорния, в ноябре 1992 года. При воздействии применяли одиночный импульс длительностью 3–15 мс и энергию 10–20 Дж/см2, отсекающий фильтр 515 нм, охлаждение не применялось, для вен диаметром от 0,2 до 1 мм не использовали световод. Пациенты с проблемами вен наблюдали на протяжении 6 недель, а пациентов с винными пятнами в течение 4 недель.
Превосходный результат наблюдался в 60 % вен и винных пятен, однако ожог эпидермиса случался в 40 % случаях, а образование рубцов встречалось у 20 % пациентов. Такой результат повлек дальнейшие исследования, чтобы определить оптимальные параметры IPL для минимизации повреждения эпидермиса. Таким образом, было проведено одобренное наблюдательным советом учреждения исследование с участием человека, по итогам которого были выработаны параметры лечения с использованием последовательного мультиимпульса и различных фильтров от 550 до 570 и 590 нм, чтобы отсекать более низкий диапазон волн с максимальным излучением импульсной лампы, составлявшим около 800 нм. Повышенной защиты эпидермиса достигали за счет применения кварцевого световода и охлаждающего светопроводящего геля, что позволяло свету достигать целевых структур, предотвращая перегрев эпидермиса.
Результаты этого исследования с участием человека были представлены в рамках лекции «Может ли свет быть полезным при лечении телеангиэктазий нижних конечностей и сетчатых вен?» (“Can Light Be Useful in the Management of Lower Extremity Telangiectasia and Reticular Veins?”) в декабре 1993 года на 53-м ежегодном мероприятии Академии дерматологии (Academy of Dermatology) в Новом Орлеане, Лос-Анджелес [3]. В 1994 году Goldman и Fitzpatrick опубликовали теоретическое обоснование применения IPL при лечении доброкачественных сосудистых поражений в учебном пособии с наименованием «Лазерная хирургия кожи: искусство и наука селективного фототермолиза» (“Cutaneous Laser Surgery: The Art and Science of Selective Photothermolysis”) [4].
После успешных результатов в отношении вен на ногах ученые в мае 1995 года начали лечить телеангиэктазии на лице, гипертрофические рубцы, гемангиомы и патологические вены и добились превосходных результатов. Приход IPL не обошелся без критики. В августе 1995 года FDA выдал одобрение на применение первых IPL-устройств. Более 20 систем Photoderm начали клинически испытывать в США и еще 20 в Канаде и Европе, многие доктора сообщали об успешном применении IPL-систем, тогда как другие часто наблюдали осложнения, в том числе ожог эпидермиса, в результате чего возник уничижительный термин «фотоожог», применявшийся при описании этой технологии [3].
В 1996 году Goldman и Eckhouse опубликовали первую крупную работу в журнале Dermatologic Surgery and Cosmetic Surgery, где описывали прекрасные результаты своего мультицентрового исследования на примере вен на ногах [5]. Доктора Robert и Margaret Weiss дополнили публикацию редакционной статьей, обсуждавшей осложнения метода, но пришли к выводу, что накопленный опыт чаще всего является лучшим учителем [6]. Dover и соавторы [7] обсуждали различные результаты лечения вен на ногах методом IPL, что сократило частоту его применения в отношении телеангиэктазий на ногах. В то же время лечение доброкачественных пигментных и сосудистых поражений с использованием IPL получило популярность как опция омоложения кожи [8, 9].
В августе 1996 года Доктор Goldman лечил винные пятна на лице у мужчины, от которых не мог избавиться в результате множества сеансов лечения импульсным лазером на красителе и обычно скрывал под усами. Винные пятна после одного IPL-сеанса стали светлее на 50 %, а плотность роста волос в области усов уменьшилась на 50 %. Такой побочный эффект расширил клиническое применение IPL. Вскоре после этого открытия доктор Goldman воздействовал при помощи IPL на свою собственную спину. Биопсия кожи спины демонстрировала успешную термокоагуляцию волосяных фолликулов.
Дальнейшие клинические исследования проводились на трансгендерных мужчинах в Берлине (Германия), что помогло разработать IPL-устройство высокой мощности с более быстрой подзарядкой. Это устройство известно как Epilyte™ [3]. На ранних этапах развития IPL многие доктора были недовольны необходимостью технических навыков для достижения последовательных и успешных результатов применения IPL.
23 июня 1996 года газета The New York Times опубликовала статью под названием “Unsightly veins? Zap Wall St. Woes? Zap”, которая пестрила цитатами врачей, сомневавшихся в пользе и безопасности IPL. Доктор Harvey Jay, MD, опубликовал письмо редактору, объясняя, что работу с IPL можно сравнить с работой опытного хирурга со скальпелем, когда начинающий не сможет достигать необходимого эффекта, а эксперт в свою очередь будет добиваться прекрасных результатов [3].
Доктор David Green опубликовал в Journal of the American Academy of Dermatology статью, в которой детально расписывал свои наблюдения, в том числе высокий уровень побочных явлений и недовольства пациентов IPL [10]. На ежегодной встрече Коллегии Американского общества лазерной медицины и хирургии (American Society for Laser Medicine and Surgery) доктору Goldman задали вопрос, почему он не согласен с недавно вышедшей статьей доктора Green. Он ответил на вопрос в стиле Dr. Jay, использованному в письме редактору. Тогда доктор Green подал на доктора Goldman заявление о клевете в Верховный уголовный суд Сан Диего (San Diego Supreme Criminal Court). В итоге доктору Green не присудили никаких выплат за эти комментарии. Таким образом, очевидно, что ранние этапы IPL не обошлись без споров [11].
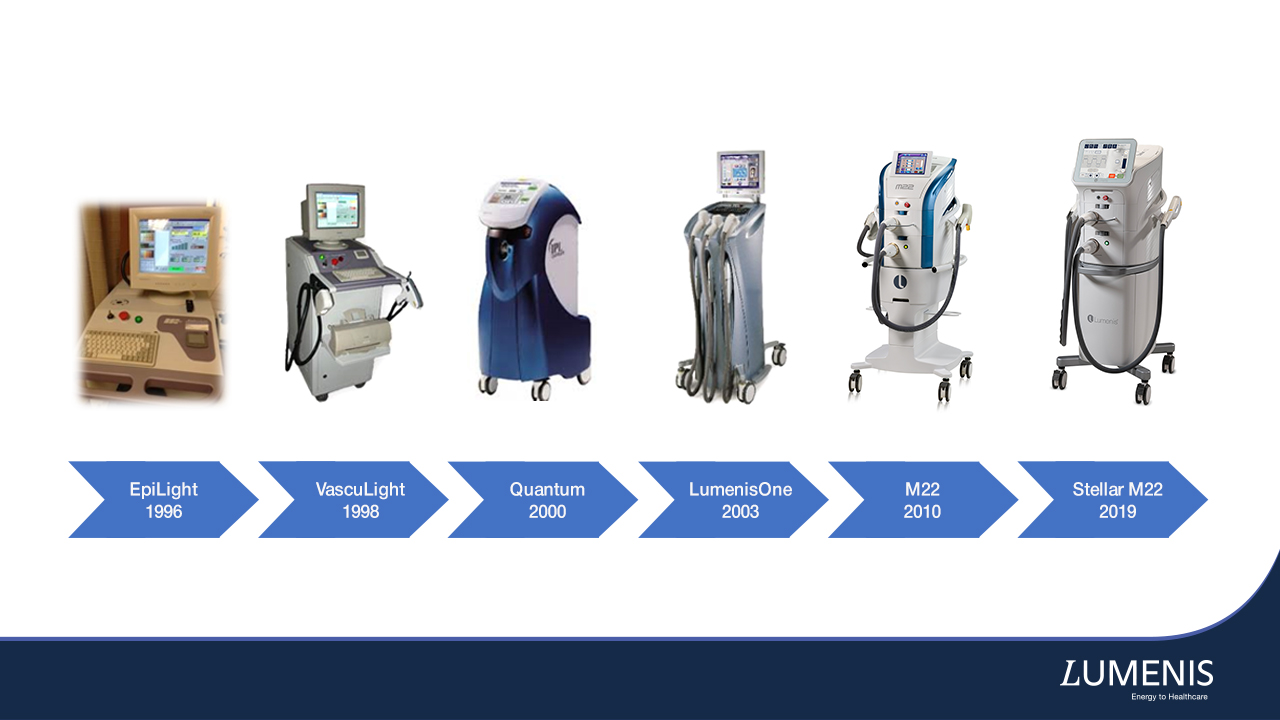
IPL выдержал первоначальную критику и в настоящее время является наиболее универсальным инструментом в арсенале косметологов. Он применяется для лечения доброкачественных пигментных новообразований и сосудистых поражений кожи, а также в составе фотодинамической терапии (ФДТ) поверхностного немеланоцитарного рака кожи, акне и фотостарения кожи [12–14]. Следует отметить, что современные IPL-системы (такие как Lumenis M22) используют технологию оптимизации импульса, обеспечивающую равномерную подачу энергии на протяжении всего импульса. Это значимое техническое улучшение по сравнению с предшествующими моделями, которые выдавали пиковую энергию, после которой следовал спад [12].
Итак, IPL преодолел раннюю критику и сейчас является одним из наиболее универсальных инструментов в арсенале врача-косметолога. Сравнительно невысокая стоимость аппаратов и отсутствие расходных материалов делают IPL рентабельной рабочей лошадкой в интенсивной косметологической практике клиник. Он используется для лечения доброкачественных пигментных новообразований и сосудистых поражений кожи, а также в составе фотодинамической терапии (ФДТ) поверхностного немеланоцитарного рака кожи, акне и фотостарения [13–14].

Stellar M22 включает 4 неинвазивных лазерных/IPL модуля для проведения более 100 вариантов процедур в косметологии, дерматологии и офтальмологии. По совокупности характеристик Stellar M22 превосходит любой аналог. Использование этого аппарата обеспечит вам выдающиеся результаты при лечении самых разных показаний и даже тогда, когда другие методики не эффективны.
IPL-устройства испускают некогерентный полихроматический свет в широком диапазоне длин волн от 400 до 1200 нм. Это позволяет IPL воздействовать на ряд хромофоров (гемоглобин, меланин и воду). Диапазон длин волн света, испускаемого устройством, можно регулировать при помощи отсекающих фильтров 515, 560, 590, 615, 640, 695 и 755 нм.
Производители продолжают добавлять новые фильтры к своим устройствам, например, Lumenis разработал сменный сосудистый фильтр двойного спектра 530–650 и 900–1200 нм и фильтр акне с длинами волн 400–600 и 800–1200 нм. Таким образом, IPL-устройства способны воздействовать на целевые ткани по принципу селективного фототермолиза.
В настоящее время на рынке имеется более 20 различных IPL-устройств. Некоторые из них выдают одиночный импульс, тогда как другие — множественные последовательные импульсы (последовательный мультиимпульс). Кроме того, в некоторых системах можно менять длительность импульса, флюенс или сразу оба параметра в каждом импульсе. К другим переменным относится размер пятна, параметры энергии, длительность импульса, наличие встроенного охлаждения.
Одним из примеров популярных IPL-устройств являются системы производства компании Lumenis. В зависимости от применяемого фильтра, устройства способны испускать свет с длинами волн от 515 до 1200 нм. Охлаждаемый сапфировый наконечник, размещаемый в рукоятке устройства является полезной функцией, которой оснащены некоторые системы, он обеспечивает защиту эпидермиса, в то же время позволяя использовать больший флюенс для воздействия на ткани на большей глубине.
Охлаждающий светопроводящий гель следует наносить на участки лечения IPL для защиты эпидермиса и предотвращения рассевания тепла. Кроме того, гель уменьшает коэффициент преломления света, тем самым способствуя более эффективному воздействию и поглощению света, а также обеспечивает легкое скольжение рукоятки по коже.
Чтобы ограничить термическое повреждение нецелевых тканей, длительность импульса должна быть меньше времени термической релаксации целевых тканей. Время термической релаксации определяется как время, необходимое для того, чтобы пиковая температура в нагреваемом участке тканей снизилась до 37 % общей температуры нагрева [15]. Обеспечение надлежащего времени термической релаксации между импульсами теоретически предотвращает нагрев эпидермиса выше 70 °C и является преимуществом, свойственным технологии последовательного мультиимпульса, реализованной в некоторых IPL-системах, например, IPL-устройствах Lumenis.
Для стандартной толщины эпидермиса 100 мкм время термической релаксации составляет примерно 1 мс. Для обычного сосуда диаметром 100 мкм (0,1 мм) время термической релаксации составляет около 10 мс. Поэтому сосуды > 0,3 мм охлаждаются медленнее, чем эпидермис в одиночном импульсе. Для крупных сосудов, однако, мультиимпульс может быть предпочтителен.
Время задержки между последовательными импульсами должно составлять 10 мс и более, чтобы обеспечить оптимальное время термической релаксации; 20–40 мс термической релаксации рекомендуется для пациентов с темными типами кожи во избежание термического повреждения эпидермиса [16]. Мы рекомендуем дополнительно к контактному охлаждению кожи сапфировым наконечником использовать внешнее воздушное охлаждение для менее болезненной и более эффективной процедуры.
4.1.1. Лентигиноз
IPL показал эффективность при лечении пигментных дисхромий, особенно эпидермальных пигментных нарушений, таких как веснушки и эфелиды [17–27]. Множество исследований в равной степени сообщали о прекрасных результатах и безопасности IPL при лечении солнечного лентиго и эфелидов на лице и теле после курса из 3–5 процедур. IPL можно безопасно применять на темных типах кожи, если при этом использовать двойной или тройной импульс и 30–40 мс задержку между импульсами, поскольку это позволяет оставлять эпидермис неповрежденным [27].
Kawada и соавторы [19] показали, что движение меланоцитов и их последующее удаление происходит через отшелушивание микрокорочек с поверхности кожи на участках воздействия IPL. Группа ученых использовала метод видеомикроскопической оценки и гистологический анализ, чтобы показать, что формирование микрокорочек ограничено пигментными пятнами и что эти микрокорочки содержат меланин, как было продемонстрировано при окрашивании методом Фонтана–Массона. Кроме того, в базальном слое в области лечения оставалось меньше меланина, чем на участках с пятнами, воздействие на которые не производилось. Отшелушивание корочек приводило к клиническому очищению кожи от солнечного лентиго.
Friedmann и Peterson [18] сообщали, что применение в IPL фильтра, схожего по длинам волн с KTP (525–585), в лечении солнечного лентиго на лице и руках является хорошо переносимым и эффективным методом лечения. В одном хорошо выстроенном рандомизированном слепом сравнительном (левая сторона – правая сторона) исследовании с участием 32 тайваньских женщин, из которых 17 имели эфелиды и 15 солнечное лентиго, сравнивали эффективность IPL и QS александритового лазера (QSAL) [27], который широко применяют при коррекции веснушек.
Исследование показало, что обе опции давали существенное улучшение индекса площади и выраженности пигментации (PASI) после одного сеанса лечения QSAL или двух IPL-процедур. QSAL более эффективен в отношении эфелидов, тогда как IPL и QSAL равнозначны в отношении солнечного лентиго. Важно отметить, что поствоспалительная гиперпигментация (PIH) наблюдалась у 8 пациенток с эфилидами и одной с солнечным лентиго на той стороне лица, которую лечили при помощи QSAL, и не наблюдалась на стороне, на которую воздействовали интенсивным импульсным светом. Веснушки могут сопровождать различные заболевания кожи, включая синдром Пейтца-Егерса-Турена и синдрома LEOPARD.
При этих заболеваниях гистология схожа с простым лентиго с той небольшой разницей, что при синдроме Пейтца-Егерса-Турена более глубоко меланизированы меланосомы [28], а при синдроме LEOPARD больше их размер [29]. Отчеты о клинических случаях показывают значительное клиническое улучшение веснушек, ассоциированных с этими двумя синдромами [23, 24]. IPL уверенно показывает свою безопасность и эффективность при лечении солнечного лентиго и эфелидов.
IPL может быть предпочтительнее QSAL при лечении лентигинозной болезни у азиатской популяции пациентов в связи с возможным риском поствоспалительной гиперпигментации после QSAL.
4.1.2. Мелазма
Имеющиеся данные позволяют предположить, что повышенная васкуляризация является одним из главных признаков мелазмы [30]. Сосудистый эндотелиальный фактор роста (VEGF) может быть главным ангиогенным фактором для измененных сосудов при мелазме. Недавний мета-анализ показал уменьшение индекса площади и тяжести мелазмы (MASI) после IPL-терапии на 39 % [31]. Множество исследований показывают умеренную эффективность лечения [32–37].
В одном сравнительном «split-face» исследовании мелазмы [38] на одну половину лица воздействовали импульсным лазером на красителе (PDL – импульсный лазер на красителе), а на другую половину IPL. Клиническую эффективность измеряли с использованием модифицированного индекса площади и тяжести мелазмы (mMASI). Для оценки VEGF проводили биопсию тканей с иммуногистохимическим окрашиванием.
Показатели mMASI значительно уменьшались в обеих группах. Однако исследование показало более высокую эффективность IPL в отношении поражений с эпидермальной мелазмой или мелазмой со значительной сосудистой составляющей. Уровень экспрессии VEGF существенно снижался в обеих группах.
В рандомизированном контролируемом исследовании, проведенном Wang и соавторами [36], IPL достигал гораздо более значимых результатов, чем в группе, пациентов которой лечили наружно – гидрохиноном и солнцезащитными средствами (40%-е улучшение количественного индекса меланина в первой группе по сравнению с 11%-м улучшением во второй). Последующее рандомизированное контролируемое исследование сравнивало исследуемую группу пациентов при IPL-терапии с контрольной группой, пациентов которой лечили трехкомпонентным кремом: флуоцинолона ацетонид 0,01 %; гидрохинон 4 %; тритиноин 0,05 % и солнцезащитными средствами.
Исследование показывало статистически значимое улучшение MASI в исследуемой IPL-группе по сравнения с контрольной [39]. В своем проспективном сравнительном (правая сторона – левая сторона) исследовании Goldman и соавторы [40] демонстрировали, что комбинация IPL и трехкомпонентного наружного средства была эффективнее, чем монотерапия IPL.
Na и соавторы [34] в своем ретроспективном сравнении полагали, что добавление IPL к лечению Nd:YAG-лазером с низким флюенсом было эффективнее при лечении мелазмы, чем использование Nd:YAG-лазера с низким флюенсом в качестве монотерапии [34]. Эти выводы соответствовали недавнему исследованию Vachiramon и соавторов [41]. Топическое нанесение и пероральный прием транексамовой кислоты показали перспективы в лечении мелазмы [42–44]. Важно отметить, что IPL-терапию до сих пор не изучали в прямом сравнительном исследовании с группой лечения транексамовой кислотой.
Таким образом, имеющиеся свидетельства показывают, что IPL может приводить к улучшениям у пациентов с мелазмой, устойчивой к топической терапии. Однако метод может ассоциироваться с риском рецидива при отмене терапии наружными средствами. Ответ на IPL- воздействие может также быть связан с типом мелазмы, и более благоприятным ответом при эпидермальной, чем при дермальной мелазме или смешанных ее типах.
4.1.3. Пойкилодермия Сиватта
IPL также эффективен в лечении пойкилодермии Сиватта [45–47]. Исследования единодушно показывали от заметного до существенного уменьшения сосудистых, пигментных и атрофических изменений кожи у 81–82 % пациентов после трех–пяти сеансов фототерапии.
Одно из гистологических исследований показало гомогенизацию распределения меланина после IPL-терапии (86 % пациентов) и уменьшение диаметра сосудов более чем на 50 % в поверхностном сосудистом сплетении (57 % пациентов). Кроме того, гистологический анализ показывал больший диаметр фибробластов, увеличение нефрагментированных волокон эластина, утолщение и уплотнение коллагеновых волокон [46]. Таким образом, применение IPL в терапии пойкилодермии Сиватта уверенно демонстрирует безопасность и эффективность, принимая во внимание факт, что он воздействует на три компонента, лежащие в основе патогенеза пойкилодермии Сиватта, а именно сосуды, пигмент и дряблость кожи.
4.2.1. Acne vulgaris (акне)
В нескольких исследованиях метод IPL изучали применительно к лечению акне, в том числе и как отдельную опцию, и в качестве усилителя ФДТ [48–63]. Имеется несколько предложенных механизмов действия IPL на акне. Одним из них является термолиз кровеносных сосудов, питающих сальные железы. Он приводит к уменьшению выработки кожного сала и размера желез. Этот вывод поддерживает исследование Barakat и соавторов [64], которые проводили гистопатологический анализ и измерение общей площади сальных желез до лечения и через две недели после курса из шести сеансов IPL.
Исследование показало значительное сокращение площади сальных желез после IPL-терапии. IPL также обладает противовоспалительным эффектом за счет обратной регуляции фактора некроза опухолей альфа (TNF-α) и регуляции сигнального пути трансформирующего фактора роста бета 1 гена smad3 [65–67].
Chang и соавторы [48] проводили открытое проспективное исследование «split-face» с участием 30 корейских женщин с акне от легкой до умеренной степени тяжести и обнаружили, что IPL-терапия с использованием фильтра акне 530–750 нм приводило к улучшению состояния красных макул, неравномерной пигментации и тона кожи, но не влияла на количество очагов воспалительного акне.
Эти результаты также подтвердили Yeung и соавторы [61], исследовавшие эффективность IPL с участием 30 китайских пациентов. Значительное большинство исследований IPL на пациентах с акне показывало сокращение как воспалительных, так и невоспалительных очагов [49, 57, 68].
Описанная эффективность IPL в отношении акне ранжировалась от 34 до 88 % со средним улучшением на 40–60 %. Количество IPL-сеансов в этих исследованиях ранжировалось от 4 до 8. Большая эффективность IPL в лечении акне была показана при его сочетании с ФДТ по сравнению с IPL в качестве монотерапии. Наиболее часто сообщается об эффективности в диапазоне между 60 и 80 % [54, 58].
Shaaban и соавторы [58] сравнивали безопасность и эф- фективность ФДТ с внутриочаговым введением 5-аминолевулиновой кислоты (5-АЛК) в сочетании с IPL и IPL в качестве монотерапии при лечении акне. Авторы проводили открытое проспективное исследование «split-back» с участием 30 пациентов. У всех тридцати наблюдалось уменьшение количества очагов акне на обеих сторонах спины, но сокращение было значительно больше и рецидив случался значительно реже в группе ФДТ и IPL, чем в группе IPL.
В рандомизированном исследовании с контрольной плацебо-группой Mei и соавторы [54] сравнивали АЛК–IPL–ФДТ и монотерапию IPL при лечении 41 пациента с акне на лице от умеренной до тяжелой форм и обнаружили, что в первой группе результат был лучше с точки зрения уменьшения общего количества очагов акне и специфических воспалительных и невоспалительных поражений.
В ходе 12-недельного наблюдения после курса из четырех сеансов наблюдалось 75%-е улучшение общего количества очагов в группе АЛК–IPL–ФДТ против 51%-го улучшения в группе монотерапии IPL. В ретроспективном 10-летнем одноцентровом исследовании, сравнивавшим множество источников света в последовательной активации ФДТ в отношении акне вулгарис, Friedmann и соавторы выяснили [63], что у пациентов, которых лечили комбинацией синего света и IPL, была значительно ниже частота вспышек акне.
4.2.2. Розацеа
Ранние исследования показывали эффективность IPL в уменьшении циркуляции крови, телеангиэктазий и выраженности эритемы у пациентов с розацеа [69, 70]. Эти выводы были подтверждены в проспективном исследовании с участием 60 пациентов (типы кожи I–IV по Фицпатрику), проходивших в среднем по 4 сеанса, в результате которых достигалось 78%-е улучшение. Эти результаты подтверждались данными 3-летнего периода наблюдения после лечения [71].
Papageorgiou с коллегами обнаружили, что IPL значительно улучшает эритему и телеангиэктазии в эритематозно-телеангиэктатическом типе розацеа после 4 сеансов, проведенных с трехнедельным интервалом. Результаты сохранялись на протяжении как минимум 6 месяцев после лечения [72]. В прямом сравнительном рандомизированном одностороннем слепом исследовании «splitface », сравнивавшим не вызывающий пурпуры импульсный лазер на красителе с IPL при лечении эритематозно-телеангиэктатическом типа розацеа Neuhaus и соавторы [73] обнаружили, что оба метода были одинаково эффективны в уменьшении эритемы кожи, телеангиэктазии и сообщавшихся пациентами симптомов и что оба метода существенно улучшали состояние кожи по сравнению с контрольными участками, не подвергавшимися лечению.
В другом проспективном сравнительном (правая сторона – левая сторона) исследовании Fabi с коллегами показали, что терапевтическую эффективность IPL при розацеа можно и далее повышать за счет добавления топической терапии 15 % азелаиновой кислоты [73]. В одном отчете описан клинический случай эффективного лечения одного пациента с гранулематозной розацеа при помощи IPL. У пациента заболевание ранее было устойчивым к топической терапии клиндамицином, метронидазолом, азелаиновой кислотой, ингибиторами кальценеврина и пероральному приему доксициклина [74].
Одно проспективное обсервационное исследование показало улучшение эритемы и у пациентов с эритематозно-телеангиэктатическом типом розацеа, и у пациентов с папуло-пустульной розацеа после трех сеансов IPL с интервалом в три недели. По мнению врача, состояние эритемы улучшалось в два раза в группе папуло-пустульной розацеа и в 1,4 раза в группе эритематозно-телеангиэктатического типа розацеа [75].
В целом IPL является эффективной, хорошо переносимой опцией терапии розацеа с эффективностью равной эффективности импульсных лазеров на красителе. Как правило, улучшение в среднем составляет 50 %.
IPL изначально был разработан для лечения вен на ногах и показал себя успешным при лечении большого круга сосудистых поражений кожи и при процессе течения заболевания. Goldman и Raulin сообщали о первом успешном лечении взрослого пациента с винным пятном при помощи IPL в 1997 году [76]. Винное пятно было устойчивым к терапии импульсным лазером на красите, но прошло после 4 сеансов фототерапии. Похожим образом Bjerring и соавторы [77] в своем исследовании лечили 15 пациентов с устойчивыми к терапии винными пятнами при помощи IPL и добивались 75-100%-го очищения кожи в 46,7 % случаев.
В 1999 году ретро- спективное исследование 40 винных пятен показало, что 75 % винных пятен после терапии IPL достигали 75-100%-го осветления после 1–4 сеансов [78]. Имелись противоречивые результаты относительной эффективности PDL и IPL в лечении винных пятен [79]. Рандомизированное контролируемое односторонне слепое прямое сравнительное исследование анализировало PDL с IPL при лечении винных пятен и показывало, что оба метода эффективны. Однако PDL был эффективнее в плане медианного клинического улучшения (65 % против 40 %), что стимулировало пациентов выбирать PDL-терапию [80].
Babilas и соавторы [81] сравнивали IPL со стандартным методом лечения винных пятен – PDL. Они обнаружили, что IPL превосходил по результатам короткоимпульсный PDL (0,45 мс) и был равнозначен длинноимпульсному PDL (1,5 мс) при лечении винных пятен [81]. PDL считался стандартом лечения телеангиэктазий с 90-х годов [82]. PDL может давать остаточную пурпуру за счет быстрого нагрева кровеносных сосудов короткими импульсами (0,45 мс), а при большой ширине импульса (до 40 мс) нагрев кровеносных сосудов медленный, что уменьшает риск пурпуры, но может и снижать эффективность [83].
PDL претерпел изменения до длинноимпульсных устройств (до 40 мс), и вместе с тем изменились протоколы лечения, которые предусматривают суммирование импульсов, множественный импульс и разные длины волн для минимизации побочных эффектов [82, 84–89]. Способность IPL снижать вероятность пурпуры и лечить большие площади, благодаря большему размеру пятна, делает его идеальной опцией лечения телеангиэктазий [13].
Обзор, сделанный Wat и соавторами [79], обнаружил подтверждение успеха в лечении большого разнообразия телеангиэктазий при помощи IPL, включая доброкачественные эссенциальные телеангиэктазии, телеангиэктазии нижних конечностей, наследственные геморрагические телеангиэктазии, телеангиэктазии, спровоцированные радиотерапией, постхирургические телеангиэктазии и телеангиэктазии, ассоциированные с системным склерозом.
Как было упомянуто ранее, на начальных этапах развития IPL был призван лечить вены на ногах. Goldman и коллеги лечили 159 пациентов с те- леангиэктазиями на нижних конечностях при помощи IPL и обнаружили, что у 79 % пациентов очищение кожи от сосудов составляло 75–100 % [6]. Tanghetti проводил рандомизированное «split-face» исследование телеангиэктазий на лице и сравнивал PDL и IPL, которые показывали одинаковую эффективность и схожий профиль побочных эффектов, включая эритему, постпроцедурный отек и пурпуру, которые проходят в течение нескольких дней. Один пациент имел следы гиперпигментации после IPL, которая проходила в течение месяца [82].
Clementoni и коллеги анализировали 1000 пациентов с типами кожи I–IV по Фицпатрику с телеангиэктазиями, которых лечили IPL, и обнаружили, что у 89,7 % наблюдалось 75-100%-е улучшение. Пациенты, прошедшие три или более сеансов, отмечали существенное улучшение качества кожи в целом [90].
IPL — эффективная, хорошо переносимая опция лечения телеангиэктазий с сопутствующим улучшением общего качества кожи.
Актинический кератоз (AK) – это диспластические эпидермальные опухолевые новообразования, возникающие в связи с хроническим воздействием ультрафиолета. Факторами риска является возраст, пол (в большей степени мужской), типы кожи I/II по Фицпатрику, загар, работа или увлечения, связанные с длительным пребыванием на солнце. Новообразования, как правило, локализованы на лице, скальпе без волос, шее, тыльной стороне кистей рук, предплечьях и верхней части торса [91].
Следует отметить, что 65–97 % случаев плоскоклеточной карциномы (SCC) развиваются из AK или на участках поле канцеризации [92]. Warino и соавторы [93] обнаружили, что причиной примерно 5,2 миллионов визитов к врачам ежегодно в период между 1995 и 2003 годами было обследование на предмет AK. В связи с большим количеством пациентов, страдающих AK, и потенциальным его прогрессированием в инвазивную SCC, имеются эффективные стратегии лечения.
Существует множество вариантов лечения AK, но ФДТ имеет преимущество, поскольку это хорошо переносимый, рентабельный метод лечения участков диффузного AK с длительным безрецидивным периодом, прекрасным эстетическим результатом и не влекущий необходимости строгого соблюдения режима лечения пациентом [94, 95].
Некоторые исследования изучали применение IPL в качестве активатора фотосенсибилизирующих агентов для ФДТ при AK. Одно из сравнительных исследований (правая сторона – левая сторона) сравнивала IPL с IPL в сочетании с ФДТ с метиламинолевулинатом (MAL). Наблюдалось 60%-е улучшение на стороне, где использовался комбинированный метод и 55%-е при IPL в качестве монотерапии. Эти результаты позволяют полагать, что IPL в качестве монотерапии может быть эффективен при лечении AK, но его эффект можно усиливать при добавлении фотосенсибилизатора [96]. В других четырех исследованиях также изучали применение АЛК или метиламинолевулинатом (MAL) в сочетании с IPL, при этом AK очищался на 50–91 % после одной процедуры [97–100].
Kim и соавторы [100] гистологически подтверждали очищение 42 % поражений после применения 5-АЛК–ФДТ и IPL в качестве источников света. 5-Фторурацил также использовали в сочетании с IPL–ФДТ для успешного лечения AK [101]. В рандомизированном контролируемом исследовании, проведенном Haddad и соавторами, подбирали оптимальный флюенс для лечения AK.
Ответ был наилучшим в исследуемых группах, получавших лечение со следующими параметрами: 40 Дж/см2 (20 Дж/см2 × 2 прохода; p = 0,02) и 50 Дж/см2 (25 Дж/см2 × 2 прохода; p = 0,02) в сочетании ФДТ и 5-АЛК и монотерапии IPL, а также 20 и 25 Дж/см2. Следует отметить, что только у 24 % пациентов имелся заметный результат (улучшение > 75 %) [99].
Friedmann и коллеги исследовали применение устройств, в которых используются множественные последовательные импульсы для активации 5-АЛК при ФДТ актинического кератоза. Они изучали сочетание IPL, PDL и синего света в сочетании с IPL или синего света в качестве монотерапии при лечении актинического кератоза. Дополнение красного света не повышало эффективности.
Пациенты, проходившие лечение сочетанием IPL, PDL, красного и синего света имели более низкий уровень шелушения, эритемы и частоту вспышек акне, чем синий свет + IPL, и меньше болевых ощущений, чем синий свет в сочетании с PDL [102]. В целом, IPL в сочетании с ФДТ является эффективной альтернативной опцией, которая хорошо переносится пациентами при лечении актинического кератоза. Незначительное количество исследований изучали применимость IPL в лечении поверхностной базальноклеточной карциномы (BCC) и Болезни Боуэна.
Открытое исследование проводили с участием 30 пациентов, у которых присутствовал актинический кератоз, поверхностная BCC и Болезнь Боуэна. Пациентов лечили MAL pulse IPL. После двух сеансов IPL (6 импульсов, задержка 1–10 с), у всех 10 пациентов с поверхностной BСC и всех 9 пациентов с Болезнью Боуэна наблюдалось полное очищение кожи. В другом небольшом открытом иссле- довании проводили лечение трех пациентов АЛК + IPL. Все пациенты демонстрировали полное очищение кожи после 2–4 сеансов с интервалом в 2 недели.
АЛК + IPL предлагает обещающие результаты в лечении поверхностной BСС и Болезни Боуэна, однако текущее подтверждение основано на исследованиях невысокого уровня [79, 98, 103].
4.5.1. Гипертрофические и келоидные рубцы
Гипертрофические и келоидные рубцы являются следствием избыточной пролиферации фибробластов и повышенного синтеза коллагена в связи с нарушением регуляции (дисрегуляцией) процессов заживления после травмирования тканей. Клинически они являются эритематозными, возвышающимися над здоровой кожей, плотными участками и часто ассоциируются с болевыми ощущениями и зудом.
PDL широко применяют при лечении гипертрофических и келоидных рубцов, однако он может вызывать нежелательную пурпуру, которая иногда сохраняется до 2 недель [104]. Рандомизированные контролируемые исследования, оценивающие использование IPL при лечении келоидных и гипертрофических рубцов, немногочисленны, однако имеется несколько исследований, поддерживающих применение IPL, включая открытые исследование, одно ретроспективное обсервационное исследование, и проспективное сравнительное (права сторона-левая сторона) исследование, и показывающие эффективное применение IPL [104–106].
Пурпура, возникающая у пациентов после косметологического лечения, является нежелательным побочным эффектом. В проспективном «split» исследовании в общей сложности 15 рубцов после уменьшения груди и абдоминопластики лечили при помощи IPL и длинноимпульсного PDL. IPL терапия ассоциировалась с повышенными болевыми ощущениями, но вызывала меньше пурпуры по сравнению с длинноимпульсным PDL.
Различия в улучшении состояния рубцов после длинноимпульсного PDL и после IPL были статистически значимыми [104]. Исследования Kontoes и соавторов [105] демонстрировало 50 % улучшение гиперпигментированных, эритематозных и пролиферативных рубцов, которые лечили при помощи IPL (в среднем 2,97 сеансов). Erol и соавторы [106] наблюдали 109 пациентов в открытом исследовании с применением IPL. Примечательно, что высота рубца, эритема и плотность уменьшались после в среднем 8 сеансов у 92,5 % пациентов с келоидными и гипертрофическими рубцами.
IPL — эффективная процедура лечения гипертрофических и келоидных рубцов, обладающая схожей с PDL лазерами эффективностью и более низкой частотой возникновения нежелательной пурпуры.
4.5.2. Гиперплазия сальных желез
Присутствие гиперплазии сальных желез является эстетической проблемой для многих пациентов. В одном слепом исследовании 12 пациентов были случайным образом отобраны для месячного лечения 5-АЛК (30–60 мин) с последующим 15-минутным воздействием синим светом 405–420 нм (Clearlight; Lumenis Inc.) или IPL с 550 нм отсекающим фильтром (32 Дж/см2, длительностью импульса 3,5 мс, задержкой импульса 20 мс). Обе процедуры хорошо переносились.
На контрольном осмотре через 4 месяца те пациенты, которым проводили процедуры синим светом, демонстрировали в 50,6 % уменьшение выраженности поражений, а у тех, кого лечили IPL, уменьшение составляло 48,4 % [107]. Микростомия как следствие системного склероза значительно влияет на качество жизни пациентов, усложняя ведение повседневных дел и уход за полостью рта. Способность длинных волн проникать в дерму позволяет IPL замещать склеротический коллаген вновь сформированными коллагеном и эластином.
Comstedt с коллегами описывали лечение четырех пациентов IPL, у троих из которых наблюдали расширение ротового отверстия на 1 мм. У всех пациентов наблюдалось смягчение кожи в пероральной области, а также улучшение артикуляции, способности принимать пищу и облегчение ухода за полостью рта [108].
Коллоидная дистрофия кожи — редкая патология, чаще затрагивающая участки, подверженные воздействию солнца. Лечение заболевания может быть осложнено. Дермабразия, криотерапия и диатермия показывают незначительную эффективность. При лечении одного пациента успешно применяли эрбиевый YAG-лазер [109].
В одном отчете о клиническом случае 60-летняя женщина проходила 4 сеанса IPL (устройство Apollo-II Shanghai Wonderful Opto- Electric Tech Co. Ltd.). Отмечалось существенное улучшение, проявлявшееся в разглаживании кожи лица [110].
IPL хорошо переносится, имеет минимальный профиль побочных эффектов, проходящих самостоятельно. Наиболее распространенные побочные эффекты, описанные в литературе, – это легкий дискомфорт, эритема, пурпура, отек, образование пузырей и корочек. Эти проявления, как правило, проходят в течение 48 часов, но могут сохраняться до недели. В литературе также отмечают постпроцедурные гипер- и гипопигментацию как возможные побочные эффекты IPL. Изменение пигментации, как правило, поддается консервативному лечению, но в редких случаях может быть долгосрочным (до 18 месяцев).
Серьезные побочные эффекты, описанные в литературе, были крайне редки и выражались в одном случае в длительном сохранении язв, которые проходили в течение 30 дней [17], одном случае в проявлении простого герпеса губ [24] и двух случаях образования гипертрофических рубцов [111]. Профиль побочных эффектов IPL минимален при использовании корректных параметров и надлежащей квалификации врача.
IPL — эффективный метод лечения широкого круга дерматологических состояний кожи от пигментных до сосудистых и воспалительных поражений кожи. Универсальность длин волн IPL и возможность использования множества отсекающих фильтров расширяет круг показаний для этого метода. IPL-процедуры, как правило, хорошо переносятся пациентами, имеют минимальный профиль побочных эффектов, проходящих самостоятельно. Кроме того, относительная доступность аппаратов и отсутствие расходных материалов дает методу преимущество перед другими устройствами.
Доктор Goldman получил оборудование по специальной цене, проводил исследование и консультировал компанию Lumenis. Остальные авторы заявили об отсутствии у них конфликта интересов.
1. Goldman MP, Martin DE, Fitzpatrick RE, Ruiz-Esparza J. Pulsed dye laser treatment of telangiectases with and without subtherapeutic sclerotherapy. Clinical and histologic examination in the rabbit ear vein model. J Am Acad Dermatol. 1990;23(1):23-30.
2. Goldman MP, Fitzpatrick RE. Pulsed-dye laser treatment of leg telangiectasia: with and without simultaneous sclerotherapy. J Dermatol Surg Oncol. 1990;16(4):338-344.
3. Fodor L, Elman M, Ullmann Y. Aesthetic Applications of Intense Pulsed Light. Springer; 2011.
4. Goldman MPFR. Cutaneous Laser Surgery: The Art and Science of Selective Photothermolysis. Mosby- Year Book Inc; 1994.
5. Goldman MP, Eckhouse S. Photothermal sclerosis of leg veins. ESC Medical Systems, LTD Photoderm VL Cooperative Study Group. Dermatol Surg. 1996;22(4):323-330.
6. Robert Weiss MW. New treatment for telangiectases and venulectases: status of intense pulsed light therapy. Dermatol Surg. 1996;22:322.
7. Dover JS, Sadick NS, Goldman MP. The role of lasers and light sources in the treatment of leg veins. Dermatol Surg. 1999;25(4):328-335.
8. Weiss RA, Goldman MP, Weiss MA. Treatment of poikiloderma of Civatte with an intense pulsed light source. Dermatol Surg. 2000; 26(9):823-827.
9. Goldman MP, Weiss RA. Treatment of poikiloderma of Civatte on the neck with an intense pulsed light source. Plast Reconstr Surg. 2001;107(6):1376-1381.
10. Green D. Photothermal removal of telangiectases of the lower extremities with the PhotodermVL. J Am Acad Dermatol. 1998; 38(1):61-68.
11. Goldman MP. The right to disagree and the loss of academic freedom: a personal experience. Cosmet Dermatol. 2001;14:61-65.
12. Gold MH, Goldman MP. 5-aminolevulinic acid photodynamic therapy: where we have been and where we are going. Dermatol Surg. 2004;30(8):1077-1083.
13. Goldman MP, Weiss RA, Weiss MA. Intense pulsed light as a nonablative approach to photoaging. Dermatol Surg. 2005;31(9 Pt 2):1179-1187.
14. Nootheti PK, Goldman MP. Advances in photorejuvenation and the current status of photodynamic therapy. Expert Rev Dermatol. 2006;1:51-61.
15. Anderson R, Parrish J. Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation. Science. 1983;220(4596):524-527.
16. Goldman MP, Weiss RA, Weiss MA. Intense pulsed light as a nonablative approach to photoaging. Dermatol Surg. 2005;31:1179-1187.
17. Bjerring P, Christiansen K. Intense pulsed light source for treatment of small melanocytic nevi and solar lentigines. J Cutan Laser Ther. 2000;2(4):177-181.
18. Friedmann DP, Peterson JD. Efficacy and safety of intense pulsed light with a KTP filter for the treatment of solar lentigines. Lasers Surg Med. 2019;51(6):500-508.
19. Kawada A, Asai M, Kameyama H, et al. Videomicroscopic and histopathological investigation of intense pulsed light therapy for solar lentigines. J Dermatol Sci. 2002;29(2):91-96.
20. Kawada A, Shiraishi H, Asai M, et al. Clinical improvement of solar lentigines and ephelides with an intense pulsed light source. Dermatol Surg. 2002;28(6):504-508.
21. Kawana S, Ochiai H, Tachihara R. Objective evaluation of the effect of intense pulsed light on rosacea and solar lentigines by spectrophotometric analysis of skin color. Dermatol Surg. 2007;33(4):449-454.
22. Konishi N, Kawada A, Kawara S, et al. Clinical effectiveness of a novel intense pulsed light source on facial pigmentary lesions. Arch Dermatol Res. 2008;300(1):65-67.
23. Kontoes P, Vlachos S, Marayiannis K. Intense pulsed light for the treatment of lentigines in LEOPARD syndrome. Br J Plast Surg. 2003;56(6):607-610.
24. Remington BK, Remington TK. Treatment of facial lentigines in Peutz–Jeghers syndrome with an intense pulsed light source. Dermatol Surg. 2002;28(11):1079-1081.
25. Sasaya H, Kawada A, Wada T, Hirao A, Oiso N. Clinical effectiveness of intense pulsed light therapy for solar lentigines of the hands. Dermatol Ther. 2011;24(6):584-586.
26. Tanaka Y, Tsunemi Y, Kawashima M. Objective assessment of intensive targeted treatment for solar lentigines using intense pulsed light with wavelengths between 500 and 635 nm. Lasers Surg Med. 2016;48(1):30-35.
27. Wang C-C, Sue Y-M, Yang C-H, Chen C-K. A comparison of Qswitched alexandrite laser and intense pulsed light for the treatment of freckles and lentigines in Asian persons: a randomized, physicianblinded, split-face comparative trial. J Am Acad Dermatol. 2006;54(5):804-810.
28. Lucky PA, Nordlund JJ. The biology of the pigmentary system and its disorders. Dermatol Clin. 1985;3(2):197-216.
29. Fryer P, Pope F. Accumulation of membrane-bound melanosomes occurs in Langerhans cells of patients with the Leopard syndrome. Clin Exp Dermatol. 1992;17(1):13-15.
30. Kim EH, Kim YC, Lee E-S, Kang HY. The vascular characteristics of melasma. J Dermatol Sci. 2007;46(2):111- 116.
31. Yi J, Hong T, Zeng H, et al. A meta-analysis-based assessment of intense pulsed light for treatment of melasma. Aesthetic Plast Surg. 2020;44:1-6.
32. Lee J, Na S, Cho S. Intense pulsed light and low-fluence Q-switched Nd:YAG laser elicits more rapid clinical improvement in Asian patients with melasma. Lasers Surg Med. 2011;43:974-975.
33. Li YH, Chen JZS, Wei HC, et al. Efficacy and safety of intense pulsed light in treatment of melasma in Chinese patients. Dermatol Surg. 2008;34(5):693-701.
34. Na SY, Cho S, Lee JH. Intense pulsed light and low-fluence Q-switched Nd:YAG laser treatment in melasma patients. Ann Dermatol. 2012;24(3):267-273.
35. Na SY, Cho S, Lee JH. Better clinical results with long term benefits in melasma patients. J Dermatolog Treat. 2013;24(2):112-118.
36. Wang CC, Hui CY, Sue YM, Wong WR, Hong HS. Intense pulsed light for the treatment of refractory melasma in Asian persons. Dermatol Surg. 2004;30(9):1196-1200.
37. Zoccali G, Piccolo D, Allegra P, Giuliani M. Melasma treated with intense pulsed light. Aesthetic Plast Surg. 2010;34(4):486-493.
38. Hassan AM, Elfar NN, Rizk OM, Eissa NY. Pulsed dye laser versus intense pulsed light in melasma: a split-face comparative study. J Dermatolog Treat. 2018;29(7):725-732.
39. Figueiredo Souza L, Trancoso Souza S. Single-session intense pulsed light combined with stable fixed-dose triple combination topical therapy for the treatment of refractory melasma. Dermatol Ther. 2012;25(5):477-480.
40. Goldman MP, Gold MH, Palm MD, et al. Sequential treatment with triple combination cream and intense pulsed light is more efficacious than sequential treatment with an inactive (control) cream and intense pulsed light in patients with moderate to severe melasma. Dermatol Surg. 2011;37(2):224-233.
41. Vachiramon V, Sirithanabadeekul P, Sahawatwong S. Low-fluence Q-switched Nd:YAG 1064-nm laser and intense pulsed light for the treatment of melasma. J Eur Acad Dermatol Venereol. 2015;29(7):1339-1346.
42. Ebrahimi B, Naeini FF. Topical tranexamic acid as a promising treatment for melasma. J Res Med Sci. 2014;19(8):753.
43. Lee HC, Thng TGS, Goh CL. Oral tranexamic acid (TA) in the treatment of melasma: a retrospective analysis. J Am Acad Dermatol. 2016;75(2):385-392.
44. Na J, Choi S, Yang S, Choi H, Kang H, Park KC. Effect of tranexamic acid on melasma: a clinical trial with histological evaluation. J Eur Acad Dermatol Venereol. 2013;27(8):1035-1039.
45. Rusciani A, Motta A, Fino P, Menichini G. Treatment of poikiloderma of Civatte using intense pulsed light source: 7 years of experience. Dermatol Surg. 2008;34(3):314-319.
46. Scattone L, de Avelar Alchorne MM, Michalany N, Miot HA, Higashi VS. Histopathologic changes induced by intense pulsed light in the treatment of poikiloderma of Civatte. Dermatol Surg. 2012;38(7pt1):1010-1016.
47. Weiss RA, Goldman MP, Weiss MA. Treatment of poikiloderma of Civatte with an intense pulsed light source. Dermatol Surg. 2000;26(9):823-828.
48. Chang SE, Ahn SJ, Rhee DY, et al. Treatment of facial acne papules and pustules in Korean patients using an intense pulsed light device equipped with a 530-to 750-nm filter. Dermatol Surg. 2007;33(6):676- 679.
49. Choi Y, Suh H, Yoon M, Min S, Lee D, Suh D. Intense pulsed light vs. pulsed-dye laser in the treatment of facial acne: a randomized split-face trial. J Eur Acad Dermatol Venereol. 2010;24(7):773-780.
50. De Leeuw J, Van Der Beek N, Bjerring P, Martino Neumann HA. Photodynamic therapy of acne vulgaris using 5-aminolevulinic acid 0.5% liposomal spray and intense pulsed light in combination with topical keratolytic agents. J Eur Acad Dermatol Venereol. 2010;24(4):460-469.
51. Hong JS, Jung JY, Yoon JY, Suh DH. Acne treatment by methyl aminolevulinate photodynamic therapy with red light vs. intense pulsed light. Int J Dermatol. 2013;52(5):614-619.
52. Lee G-S. Inflammatory acne in the Asian skin type III treated with a square pulse, time resolved spectral distribution IPL system: a preliminary study. Laser Ther. 2012;21(2):105-111.
53. Lee WJ, Jung HJ, Kim JY, Lee SJ, Kim DW. Effect of photodynamic therapy on inflammatory acne using 3% liposomal 5-aminolevulinic acid emulsion and intense-pulsed light: a pilot study. J Dermatol. 2012;39(8):728-729.
54. Mei X, Shi W, Piao Y. Effectiveness of photodynamic therapy with topical 5-aminolevulinic acid and intense pulsed light in Chinese acne vulgaris patients. Photodermatol Photoimmunol Photomed. 2013;29(2):90-96.
55. Mohanan S, Parveen B, Annie Malathy P, Gomathi N. Use of intense pulse light for acne vulgaris in Indian skin—a case series. Int J Dermatol. 2012;51(4):473-476.
56. Rojanamatin J, Choawawanich P. Treatment of inflammatory facial acne vulgaris with intense pulsed light and short contact of topical 5-aminolevulinic acid: a pilot study. Dermatol Surg. 2006;32(8):991-997.
57. Sami NA, Attia AT, Badawi AM. Phototherapy in the treatment of acne vulgaris. J Drugs Dermatol. 2008;7(7):627-632.
58. Shaaban D, Abdel-Samad Z, El-Khalawany M. Photodynamic therapy with intralesional 5-aminolevulinic acid and intense pulsed light versus intense pulsed light alone in the treatment of acne vulgaris: a comparative study. Dermatol Ther. 2012;25(1):86-91.
59. Taub AF. A comparison of intense pulsed light, combination radiofrequency and intense pulsed light, and blue light in photodynamic therapy for acne vulgaris. J Drugs Dermatol. 2007;6(10):1010.
60. Wanitphakdeedecha R, Tanzi EL, Alster TS. Photopneumatic therapy for the treatment of acne. J Drugs Dermatol. 2009;8(3):239.
61. Yeung CK, Shek SY, Bjerring P, Yu CS, Kono T, Chan HH. A comparative study of intense pulsed light alone and its combination with photodynamic therapy for the treatment of facial acne in Asian skin. Lasers Surg Med. 2007;39(1):1-6.
62. Yeung CK, Shek SY, Yu CS, Kono T, Chan HH. Liposomeencapsulated 0.5% 5-aminolevulinic acid with intense pulsed light for the treatment of inflammatory facial acne: a pilot study. Dermatol Surg. 2011;37(4):450-459.
63. Friedmann DP, Goldman MP, Fabi SG, Guiha I. A retrospective study of multiple sequential light and laser sources to activate aminolevulinic acid in the treatment of acne vulgaris. Skinmed. 2017;15(2):105-111.
64. Barakat MT, Moftah NH, El Khayyat MA, Abdelhakim ZA. Significant reduction of inflammation and sebaceous glands size in acne vulgaris lesions after intense pulsed light treatment. Dermatol Ther. 2017;30(1):e12418. Smad3 signaling in acne-prone skin. J Cosmet Dermatol. 2013;12(3):195-203.
65. Ali MM, Porter RM, Gonzalez ML. Intense pulsed light enhances transforming growth factor beta1/Smad3 signaling in acne-prone skin. J Cosmet Dermatol. 2013;12(3):195-203.
66. Nestor MS, Swenson N, Macri A. Physical modalities (devices) in the management of acne. Dermatol Clin. 2016;34(2):215-223.
67. Taylor M, Porter R, Gonzalez M. Intense pulsed light may improve inflammatory acne through TNF-α down-regulation. J Cosmet Laser Ther. 2014;16(2):96-103.
68. Kawana S, Tachihara R, Kato T, Omi T. Effect of smooth pulsed light at 400 to 700 and 870 to 1,200 nm for acne vulgaris in Asian skin. Dermatol Surg. 2010;36(1):52-57.
69. Mark KA, Sparacio RM, Voigt A, Marenus K, Sarnoff DS. Objective and quantitative improvement of rosacea-associated erythema after intense pulsed light treatment. Dermatol Surg. 2003;29(6): 600-604.
70. Taub AF. Treatment of rosacea with intense pulsed light. J Drugs Dermatol. 2003;2(3):254.
71. Schroeter CA, Haaf-von Below S, Neumann HA. Effective treatment of rosacea using intense pulsed light systems. Dermatol Surg. 2005;31(10):1285-1289.
72. Papageorgiou P, Clayton W, Norwood S, Chopra S, Rustin M. Treatment of rosacea with intense pulsed light: significant improvement and long-lasting results. Br J Dermatol. 2008;159(3):628-632.
73. Neuhaus IM, Zane LT, Tope WD. Comparative efficacy of nonpurpuragenic pulsed dye laser and intense pulsed light for erythematotelangiectatic rosacea. Dermatol Surg. 2009;35(6):920-928.
74. Lane JE, Khachemoune A. Use of intense pulsed light to treat refractory granulomatous rosacea. Dermatol Surg. 2010;36(4):571-573.
75. Liu J, Liu J, Ren Y, Li B, Lu S. Comparative efficacy of intense pulsed light for different erythema associated with rosacea. J Cosmet Laser Ther. 2014;16(6):324-327.
76. Raulin C, Goldman MP, Weiss MA, Weiss RA. Treatment of adult port-wine stains using intense pulsed light therapy (PhotoDermVL): brief initial clinical report. Dermatol Surg. 1997;23(7):594-597.
77. Bjerring P, Christiansen K, Troilius A. Intense pulsed light source for the treatment of dye laser resistant port-wine stains. J Cosmet Laser Ther. 2003;5(1):7-13.
78. Raulin C, Schroeter CA, Weiss RA, Keiner M, Werner S. Treatment of port-wine stains with a noncoherent pulsed light source: a retrospective study. Arch Dermatol. 1999;135(6):679-683.
79. Wat H, Wu DC, Rao J, Goldman MP. Application of intense pulsed light in the treatment of dermatologic disease: a systematic review. Dermatol Surg. 2014;40(4):359-377.
80. Faurschou A, Togsverd-Bo K, Zachariae C, Haedersdal M. Pulsed dye laser vs. intense pulsed light for port-wine stains: a randomized side-by-side trial with blinded response evaluation. Br J Dermatol. 2009;160(2):359-364.
81. Babilas P, Schreml S, Eames T, Hohenleutner U, Szeimies RM, Landthaler M. Split-face comparison of intense pulsed light with short- and long-pulsed dye lasers for the treatment of port-wine stains. Lasers Surg Med. 2010;42(8):720-727.
82. Tanghetti EA. Split-face randomized treatment of facial telangiectasia comparing pulsed dye laser and an intense pulsed light handpiece. Lasers Surg Med. 2012;44(2):97-102.
83. Dierickx CC, Casparian JM, Venugopalan V, Farinelli WA, Anderson RR. Thermal relaxation of portwine stain vessels probed in vivo: the need for 1-10-millisecond laser pulse treatment. J Invest Dermatol. 1995;105(5):709-714.
84. Tanghetti E, Sherr EA, Sierra R, Mirkov M. The effects of pulse dye laser double-pass treatment intervals on depth of vessel coagulation. Lasers Surg Med. 2006;38(1):16-21.
85. Rohrer TE, Chatrath V, Iyengar V. Does pulse stacking improve the results of treatment with variablepulse pulsed-dye lasers? Dermatol Surg. 2004;30(2 Pt 1):163-167.
86. Tanghetti E, Sherr E. Treatment of telangiectasia using the multipass technique with the extended pulse width, pulsed dye laser (Cynosure V-Star). J Cosmet Laser Ther. 2003;5(2):71-75.
87. Karsai S, Roos S, Raulin C. Treatment of facial telangiectasia using a dual-wavelength laser system (595 and 1,064 nm): a randomized controlled trial with blinded response evaluation. Dermatol Surg. 2008;34(5):702-708.
88. Black JF, Wade N, Barton JK. Mechanistic comparison of blood undergoing laser photocoagulation at 532 and 1,064 nm. Lasers Surg Med. 2005;36(2):155-165.
89. Mordon S, Brisot D, Fournier N. Using a “non uniform pulse sequence” can improve selective coagulation with a Nd:YAG laser (1.06 microm) thanks to Met-hemoglobin absorption: a clinical study on blue leg veins. Lasers Surg Med. 2003;32(2):160-170.
90. Clementoni MT, Gilardino P, Muti GF, et al. Intense pulsed light treatment of 1,000 consecutive patients with facial vascular marks. Aesthetic Plast Surg. 2006;30(2):226-232.
91. Goldberg LH, Mamelak AJ. Review ofactinic keratosis. Part I: etiology, epidemiology and clinical presentation. J Drugs Dermatol. 2010;9(9):1125-1132.
92. Rosen T, Lebwohl MG. Prevalence and awareness of actinic keratosis: barriers and opportunities. J Am Acad Dermatol. 2013;68(1):S2-S9.
93. Warino L, Tusa M, Camacho F, Teuschler H, Fleischer ABJ, Feldman SR. Frequency and cost of actinic keratosis treatment. Dermatol Surg. 2006;32(8):1045-1049.
94. Tierney E, Barker A, Ahdout J, Hanke WC, Moy RL, Kouba DJ. Photodynamic therapy for the treatment of cutaneous neoplasia, inflammatory disorders, and photoaging. Dermatol Surg. 2009; 35(5):725-746.
95. Gold MH. Pharmacoeconomic analysis of the treatment of multiple actinic keratoses. J Drugs Dermatol. 2008;7(1):23-25.
96. Tadiparthi S, Falder S, Saour S, Hills SJ, Liew S. Intense pulsed light with methyl-aminolevulinic acid for the treatment of actinic keratoses. Plast Reconstr Surg. 2008;121(5):351-352.
97. Avram DK, Goldman MP. Effectiveness and safety of ALA-IPL in treating actinic keratoses and photodamage. J Drugs Dermatol. 2004;3(1 suppl):S36-S39.
98. Downs AM, Bower CB, Oliver DA, Stone CA. Methyl aminolaevulinate-photodynamic therapy for actinic keratoses, squamous cell carcinoma in situ and superficial basal cell carcinoma employing a square wave intense pulsed light device for photoactivation. Br J Dermatol. 2009;161(1):189-190.
99. Haddad A, Santos ID, Gragnani A, Ferreira LM. The effect of increasing fluence on the treatment of actinic keratosis and photodamage by photodynamic therapy with 5-aminolevulinic acid and intense pulsed light. Photomed Laser Surg. 2011;29(6):427-432.
100. Kim HS, Yoo JY, Cho KH, Kwon OS, Moon SE. Topical photodynamic therapy using intense pulsed light for treatment of actinic keratosis: clinical and histopathologic evaluation. Dermatol Surg. 2005;31(1):33-36.
101. Gilbert DJ. Treatment of actinic keratoses with sequential combination of 5-fluorouracil and photodynamic therapy. J Drugs Dermatol. 2005;4(2):161-163.
102. Friedmann DP, Goldman MP, Fabi SG, Guiha I. The effect of multiple sequential light sources to activate aminolevulinic acid in the treatment of actinic keratoses: a retrospective study. J Clin Aesthet Dermatol. 2014;7(9):20-25.
103. Hasegawa T, Suga Y, Mizuno Y, Haruna K, Ogawa H, Ikeda S. Efficacy of photodynamic therapy with topical 5-aminolevulinic acid using intense pulsed light for Bowen’s disease. J Dermatol. 2010; 37(7):623- 628.
104. Bellew SG, Weiss MA, Weiss RA. Comparison of intense pulsed light to 595-nm long-pulsed pulsed dye laser for treatment of hypertrophic surgical scars: a pilot study. J Drugs Dermatol. 2005; 4(4):448-452.
105. Kontoes PP, Marayiannis KV, Vlachos SP. The use of intense pulsed light in the treatment of scars. Eur J Plast Surg. 2003;25(7): 374-377.
106. Erol OO, Gurlek A, Agaoglu G, Topcuoglu E, Oz H. Treatment of hypertrophic scars and keloids using intense pulsed light (IPL). Aesthetic Plast Surg. 2008;32(6):902-909.
107. Gold MH, Bradshaw VL, BoringMM, Bridges TM, Biron JA, Lewis TL. Treatment of sebaceous gland hyperplasia by photodynamic therapy with 5-aminolevulinic acid and a blue light source or intense pulsed light source. J Drugs Dermatol. 2004;3(6 suppl):S6-S9.
108. Comstedt LR, Svensson Å, Troilius A. Improvement of microstomia in scleroderma after intense pulsed light: a case series of four patients. J Cosmet Laser Ther. 2012;14(2):102-106.
109. Ammirati CT, Giancola JM, Hruza GJ. Adult-onset facial colloid milium successfully treated with the long-pulsed Er:YAG laser. Dermatol Surg. 2002;28(3):215-219.
110. Rahman SB, Bari AUI, Mumtaz N. Colloid milium: a rare cutaneous deposition disease. J Pak Med Assoc. 2008;58(4):207-209.
111. Özdemir M, Engin B, Mevlitoǧlu İ. Treatment of facial port-wine stains with intense pulsed light: a prospective study. J Cosmet Dermatol. 2008;7(2):127-131.