
Авторы: Steven J. Kronowitz, M. D., Cosman Camilo Mandujano, M. D. Jun Liu, M. D., Ph. D. Henry M. Kuerer, M. D., Ph. D. Benjamin Smith, M. D. Patrick Garvey, M. D. Reshma Jagsi, M. D. Limin Hsu, M. A. Summer Hanson, M. D. Vicente Valero, M. D. Houston, Texas; and Ann Arbor, Mich
Актуальность исследования.
Хотя многие пластические хирурги проводят аутотрансплантацию жира (липофилинг) для реконструкции молочных желез после онкохирургии, до сих пор не установлено, повышает ли липофилинг, проводимый после онкохирургии, риск рецидива рака молочной железы. Авторы оценивали риск локализованного регионарного и системного рецидивов у пациентов, прошедших процедуру липофилинга в целях реконструкции молочной железы.
Методы.
Авторы отбирали в исследование всех пациентов, которым в период с июня 1981 года по февраль 2014 года были проведены следующие типы хирургических вмешательств: сегментарная или радикальная мастэктомия с последующей реконструкцией при помощи липофилинга как основного или дополнительного метода в связи с раком молочной железы (719 молочных желез), далее «основная группа», мастэктомия для снижения риска заболевания и мастэктомия при наличии доброкачественных новообразований (305 молочных желез без рака молочной железы).
Затем они также отбирали в исследование подходящих пациентов, перенесших рак молочной железы с сегментарной или радикальной мастэктомией и последующей реконструкцией без применения липофилинга (670 молочных желез), далее «контрольная группа». Вероятность возникновения локорегионарного рецидива оценивали методом Каплана ‒ Мейера.
Результаты.
Средний период наблюдения после мастэктомии составлял 60 месяцев для всех изучаемых молочных желез в основной группе, 44 месяца в контрольной группе и 73 месяца в отношении молочных желез без перенесенного рака молочной железы. Локорегионарный рецидив наблюдался в 1,3 % молочных желез в основной группе (9 из 719 молочных желез) и 2,4 % в контрольной группе (16 из 670 молочных желез). Рак молочных желез не развивался в группе без рака молочной железы в анамнезе.
Суммарный показатель 5-летнего локорегионарного рецидива составлял 1,6 и 4,1 % в основной и контрольной группах соответственно. Системный рецидив наблюдался в 2,4 % молочных желез в основной группе и в 3,6 % молочных желез в контрольной группе (p = 0,514). Первичный рак груди не появлялся в здоровых железах, в отношении которых была проведена реконструкция путем липофилинга.
Выводы.
Результаты исследования не показали увеличения локорегионарного рецидива, системного рецидива или второго случая рака молочной железы. Эти выводы подкрепляют предположение об онкологической безопасности липофилинга, применяемого для реконструкции молочных желез. (Plast. Reconstr. Surg. 137: 385, 2016.)
Опрос, проведенный среди членов Американского общества пластических хирургов в 2010 году относительно безопасности аутотрансплантации жира (липофилинга) молочных желез, показал, что для 49 % респондентов существенным препятствием применения липофилинга при реконструкции молочных желез после мастэктомии или в целях увеличения груди в эстетических целях являлась недостаточность доказательств, подтверждающих его онкологическую безопасность [1].
Озабоченность вызывает то, что взрослые стволовые клетки, полученные из подкожно-жировой клетчатки и пересаженные в составе липоаспирата, могут разбудить «спящие» раковые клетки или спровоцировать первичный рак молочной железы. Клинические исследования и исследования, проведенные с участием животных, давали противоречивые результаты [2‒5] относительно того, является ли липофилинг фактором повышенного риска рецидива.
В то время как липофилинг молочных желез проводится по всему миру тысячам пациентов ежегодно, в том числе некоторым пациентам в качестве альтернативы установке имплантов для увеличения груди, отсутствуют опубликованные исследования относительно онкологической безопасности липофилинга в целом или липофилинга молочных желез с участием контрольной группы.
Недостаточность доказательств сдерживает многих хирургов от применения липофилинга, а те, кто проводит его, могут испытывать беспокойство по поводу того, что липофилинг, возможно, повышает риск рецидива рака молочной железы.
Главной целью данного исследования было определение того, повышает ли липофилинг, проводимый в качестве основного или дополнительного метода реконструкции молочных желез, риск локорегионарного рецидива рака молочных желез. Второй целью исследования было определить, имелся ли повышенный риск развития первичного рака молочной железы у тех здоровых пациентов, кому процедуру липофилинга проводили после профилактической мастэктомии.
Институциональный наблюдательный совет Онкологического центра Андерсона Техасского университета одобрил этот ретроспективный анализ. Пациентов для анализа отбирали в два этапа. На первом этапе в проспективно поддерживаемой базе данных Департамента пластической хирургии Андерсона искали всех пациентов, которым была проведена сегментарная или радикальная мастэктомия в связи с раком молочной железы или для профилактики риска развития рака молочной железы с последующей реконструкцией с применением липофилинга как основного или дополнительного метода.
Отобранным по итогам данного поиска пациентам мастэктомия проводилась в период с июня 1981 по апрель 2013 года, липофилинг – в период с января 2001 по февраль 2014 года. Пациенты, отобранные в результате первичного поиска, были распределены на две группы: те, кому резекция молочных желез была проведена в связи с раком молочной железы (основная группа), и пациенты, которым мастэктомия была проведена в целях профилактики риска развития рака молочной железы (группа без рака в анамнезе), из них в отношении 233 пациентов была доступна информация о мутации генов BRCA (гены восприимчивости к раку молочной железы).
33 пациента были носителями мутаций генов BRCA1/ BRCA2. На втором этапе отбирали пациентов с раком молочной железы, которым мастэктомия и реконструкция молочных желез были проведены в период с июня 1981 по апрель 2013 года, но без применения липофилинга (контрольная группа).
Для оценки влияния липофилинга на риск появления локорегионарного рецидива рака молочной железы мы сравнивали молочные железы, подвергнутые реконструкции после мастэктомии, проведенной в связи с раком молочной железы, с применением липофилинга (основная группа) и без применения липофилинга (контрольная группа). Второй целью нашего исследования был поиск ответа на вопрос, действительно ли у пациентов после мастэктомии по причине снижения риска (профилактическая мастэктомия) с последующим липофилингом имеется повышенный риск первичного рака груди?
Для ответа на этот вопрос мы проанализировали две группы: группа пациентов после профилактической мастэктомии с последующим липофилингом и группа пациентов после мастэктомии из-за доброкачественного новообразования, также с последующим липофилингом.
Для обработки информации о возрасте и времени наблюдения применялись показатели описательной статистики, в частности средние значения и стандартные отклонения. Значения частоты и пропорций использовались для обобщения характеристик категорий. Демографические и клинические данные сравнивали с применением точного критерия Фишера и критерия знаковых рангов Уилкоксона.
Период безрецидивной выживаемости определялся как интервал между датой мастэктомии и датой первого локорегионарного рецидива или датой последнего контроля, если локорегионарного рецидива не наблюдалось. В отношении пациентов без локорегионарного рецидива при анализе применялось цензурирование данных. Вероятность локорегионарного рецидива оценивали с применением метода Каплана ‒ Мейера.
В связи с тем, что липофилинг часто проводили через разные промежутки времени после хирургического удаления рака, мы использовали зависимую от времени модель пропорциональной регрессии рисков Кокса для оценки влияния липофилинга на локорегионарный рецидив. Мы также использовали многофакторную модель пропорциональной регрессии рисков Кокса, чтобы учесть искажающие факторы, способные повлиять на результат (конфаундеры). Все тесты были двусторонними.
P-значения подсчитывали путем сопоставления данных пациентов с раком молочной железы в анамнезе, которым был проведен липофилинг, с теми, кому липофилинг не проводился. Значение p < 0,05 считалось статистически значимым.
Анализ проводился с использованием программ SAS 9.3 SAS Institute, Inc., Cary, N.C.) и R (The R Foundation for Statistical Computing, Vienna, Austria).
В результате первоначального поиска по базе данных отделения пластической хирургии мы отобрали 1024 молочных желез, в отношении которых была проведена реконструкция с применением липофилинга, 719 из них были молочные железы с историей рака (основная группа) и 305 ‒ молочные железы без рака в анамнезе (удаленные в целях профилактики риска развития рака молочной железы).
Из 305 молочных желез без перенесенного рака, статус генов BRCA был доступен у 233 пациентов, из которых 33 являлись носителями мутации генов BRCA1/BRCA2. Для носителей BRCA средний период наблюдения после мастэктомии составлял 33,6 месяцев, а средний интервал между операцией и липофилингом ‒ 18,4 месяцев. В результате анализа медицинской базы данных пациентов с раком молочной железы мы сопоставили 670 молочных желез с историей рака, в отношении которых была проведена реконструкция без применения липофилинга (контрольная группа).
Последний контроль этих пациентов был проведен в ноябре 2014 года. В Таблице 1 приведены характеристики пациентов и изучаемые данные.
Таблица 1. Характеристики пациентов и изучаемых данных в подгруппах
| Липофилинг | Контрольная группа |
|||||
| Переменные | Все, % | Все, липофилинг, % |
Без рака в анамнезе, % |
При раке, % |
Без липофилинга (при раке), % |
p † |
| Количество молочных желез |
1694 | 1024 | 305 | 719 | 670 | |
| Среднее время наблюдения после мастэктомии ± SD, мес. |
52,9 ± 49,3 | 60,7 ± 47,1 | 73,5 ± 56,8 | 59,6 ± 46,1 | 43,8 ± 66,7 | < 0,001 |
| Среднее время между мастэктомией и липофилингом ± SD, мес. |
– | – | 44,9 ± 55,3 | 31,5 ± 41,3 | – | |
| Средний возраст ± SD, лет |
46,9 ± 9,9 | 47,1 ± 9,6 | 45,8 ± 9,7 | 47,7 ±9,6 | 46,5 ± 10,5 | 0,039 |
| Раса | ||||||
| Европеоиды | 1238 (73,1) | 776 (75,8) | 237 (77,7) | 539 (75) | 462 (69) | |
| Афроамериканцы | 114 (6,7) | 57 (5,6) | 16 (5,2) | 41 (5,7) | 57 (8,5) | |
| Латиноамериканцы | 262 (15,5) | 149 (14,6) | 40 (13,1) | 109 (15,2) | 113 (16,9) | |
| Азиаты | 60 (3,5) | 31 (3) | 9 (3) | 22 (3,1) | 29 (4,3) | |
| Коренные американцы |
6 (0,4) | 3 (0,3) | 1 (0,3) | 2 (0,3) | 3 (0,4) | |
| Иные | 14 (0,8) | 8 (0,8) | 2 (0,7) | 6 (0,8) | 6 (0,9) | 0,142 |
| Вид мастэктомии | ||||||
| Сегментарная | 168 (9,9) | 95 (9,3) | 16 (5,2)‡ | 79 (11) | 73 (11) | |
| Итого | 1275 (75,3) | 684 (66,8) | 45 (14,8) | 639 (88,9) | 591 (88,2) | 0,999 |
| Стадия болезни | ||||||
| 0 | 305 (18) | 190 (18,6) | 16 (5,2) | 174 (24,2) | 115 (17,2) | |
| I | 488 (28,8) | 280 (27,3) | 14 (4,6) | 266 (37) | 208 (30,9) | |
| II | 467 (27,6) | 222 (21,7) | 23 (7,5) | 199 (27,7) | 245 (36,6) | |
| III | 163 (9,6) | 71 (6,9) | 6 (2) | 65 (9) | 92 (13,7) | |
| IV | 4 (0,2) | 4 (0,4) | 0 (0) | 4 (0,6) | 0 (0) | < 0,001 |
| Гистологический тип Инвазивная |
||||||
| Общее кол-во | 1144 (67,5) | 596 (58,2) | 44 (14,4) | 552 (76,7) | 548 (81,8) | |
| Инвазивный протоковый |
1009 (59,6) | 523 (51,1) | 34 (11,1) | 489 (68) | 486 (72,5) | |
| Инвазивный дольчатый |
135 (8,0) | 73 (7,1) | 10 (3,3) | 63 (8,8) | 62 (9,3) | 0,467 |
| In situ | ||||||
| Общее кол-во | 178 (10,5) | 117 (11,4) | 9 (2,9) | 108 (2,5) | 61 (9,1) | |
| DCIS | 167 (9,9) | 111 (10,8) | 8 (2,6) | 103 (14,3) | 56 (8,4) | |
| LCIS | 11 (0,6) | 6 (0,6) | 1 (0,3) | 5 (0,7) | 5 (0,7) | 0,309 |
| Расположение опухоли молочной железы (квадрант) | ||||||
| Верхне-наружный | 412 (24,3) | 228 (22,3) | 49 (16,1) | 179 (24,9) | 184 (27,5) | |
| Верхне-внутренний | 148 (8,7) | 92 (9) | 11 (3,6) | 81 (11,3) | 56 (8,4) | |
| Нижне-наружный | 67 (4,0) | 36 (3,5) | 8 (2,6) | 28 (3,9) | 31 (4,6) | |
| Нижне-внутренний | 68 (4,0) | 42 (4,1) | 11 (3,6) | 31 (4,3) | 26 (3,9) | 0,237 |
| Центричность | ||||||
| Мультифокальный | 84 (5,0) | 44 (4,3) | 5 (1,6) | 39 (5,4) | 40 (6) | |
| Мультицентрический | 174 (10,3) | 100 (9,8) | 19 (6,2) | 81 (11,3) | 74 (11) | |
| Статус гормональных рецепторов | ||||||
| ER+ | 1063 (62,8) | 570 (55,7) | 43 (14,1) | 527 (73,3) | 493 (73,6) | 0,952 |
| PR+ | 856 (50,5) | 459 (44,8) | 33 (10,8) | 426 (59,2) | 397 (59,3) | 0,999 |
| HER2/neu+§ | 126 (7,4) | 48 (4,7) | 2 (0,7) | 46 (6,4) | 78 (11,6) | 0,001 |
| Ki67+‖ | 378 (22,3) | 189 (18,5) | 16 (5,2) | 173 (24,1) | 189 (28,2) | 0,087 |
| Химиотерапия | ||||||
| Любая | 960 (56,7) | 489 (47,8) | 49 (16,1) | 440 (61,2) | 471 (70,3) | < 0,001 |
| Неоадъювантная | 501 (29,6) | 249 (24,3) | 27 (8,9) | 222 (30,9) | 252 (37,6) | 0,009 |
| Вспомогательная | 538 (31,8) | 284 (27,7) | 25 (8,2) | 259 (36) | 254 (37,9) | 0,470 |
| Лучевая терапия | ||||||
| Любая | 633 (37,4) | 337 (32,9) | 60 (19,7) | 277 (38,5) | 296 (44,2) | 0,855 |
| Неоадъювантная | 2 (0,1) | 1 (0,1) | 0 (0) | 1 (0,1) | 1 (0,1) | 0,999 |
| Вспомогательная | 631 (37,3) | 336 (32,8) | 60 (19,7) | 276 (38,4) | 295 (44) | 0,855 |
| Гормональная терапия # | ||||||
| Любая | 845 (49,9) | 474 (46,3) | 40 (13,1) | 434 (60,4) | 371 (55,4) | 0,043 |
| Тамоксифен | 554 (32,7) | 305 (29,8) | 30 (9,8) | 275 (38,2) | 249 (37,2) | |
| Ралоксифен | 3 (0,2) | 2 (0,2) | 0 (0) | 2 (0,3) | 1 (0,1) | |
| Гозерелин | 15 (0,9) | 9 (0,9) | 0 (0) | 9 (1,3) | 6 (0,9) | |
| Летрозол | 97 (5,7) | 66 (6,4) | 7 (2,3) | 59 (8,2) | 31 (4,6) | |
| Флуоксиместерон | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Эксеместан | 40 (2,4) | 27 (2,6) | 3 (1) | 24 (3,3) | 13 (1,9) | |
| Анастрозол | 300 (17,7) | 178 (17,4) | 20 (6,6) | 158 (22) | 122 (18,2) | |
| Лейпрорелин | 6 (0,4) | 2 (0,2) | 0 (0) | 2 (0,3) | 4 (0,6) | |
| Торемифен | 4 (0,2) | 3 (0,3) | 1 (0,3) | 2 (0,3) | 1 (0,1) | |
DCIS, протоковая карцинома in situ; LCIS, дольковая карцинома in situ; ER, рецептор эстрогена; PR, рецептор прогестерона; +, положительный.
* Из 305 пациентов информация о мутации генов BRCA была доступна для 228 пациентов, 33 из которых имели мутацию генов BRCA1/BRCA2 (среднее время наблюдения после мастэктомии, 33,6 мес.; среднее время до липофилинга, 18,4 мес.).
† p-значения подсчитывались при помощи зависимой от времени многофакторной модели пропорциональной регрессии рисков Кокса.
‡ Эти пациенты перенесли сегментарную мастэктомию при доброкачественных опухолях молочной железы.
§ ≥ 2 при иммуногистохимии; подтверждено флуоресцентной гибридизации in situ.
‖ Экспрессия > 17 %.
¶ Метод лучевой терапии одинаков для обеих групп.
# Средняя продолжительность гормональной терапии составляла 28,3 месяца
Средний период наблюдения после мастэктомии был значительно больше в основной группе (с липофилингом), чем в контрольной группе (без липофилинга) (59,6 месяцев и 44,0 месяцев соответственно; p < 0,001). Возраст пациентов в основной группе был выше, чем в контрольной группе (в среднем 47,7 и 46,5 лет соответственно, p = 0,039).
Данные для основной и контрольной группы также различались по стадии патологических изменений, в основной группе чаще встречались 0-1 стадии рака (p < 0,001). Локализация опухолей и гормональный статус (рецепторы эстрогена и прогестерона) в основной и контрольной группах были сопоставимы. В контрольной группе чаще встречались HER2/neu-позитивные опухоли (11,6 и 6,4 % соответственно, p = 0,001) и пациенты чаще всего получали химиотерапию (p < 0,001). В основной группе выше была вероятность получения гормональной терапии (p = 0,043).
В Таблице 2 собраны характеристики липофилинга (количество сеансов и общий объем введенного жира) для пациентов с раком и доброкачественными опухолями. Количество сеансов для двух групп было схожим. Общий объем трансплантированного жира был больше в основной группе (p = 0,007).
Таблица 2. Характеристики процедур липофилинга
| Липофилинг | ||||
| Показатели | Все пациенты, % | Пациент с раком молочной железы в анамнезе, % |
Пациенты без рака молочной железы в анамнезе, %* | p† |
| Количество молочных желез | 1024 | 719 | 305 | |
| Кол-во сеансов липофилинга | ||||
| 1 | 761 (74,3) | 527 (73,3) | 234 (76,7) | |
| 2 | 181 (7,7) | 121 (16,8) | 60 (19,7) | |
| ≥ 3 | 36 (3,5) | 36 (3,5) | 10 (3,3) | 0,772 |
| Общий объем введенного жира | ||||
| 1–100 см3 | 688 (70,3) | 449 (62,4) | 239 (78,4) | |
| 101–200 см3 | 210 (21,5) | 162 (22,5) | 48 (15,7) | |
| 201–300 см3 | 55 (5,6) | 42 (5,8) | 13 (4,3) | |
| 301–400 см3 | 18 (1,8) | 15 (2,1) | 3 (1) | |
| 401–500 см3 | 2 (0,2) | 2 (0,3) | 0 (0) | |
| > 500 см3 | 5 (0,3) | 4 (0,6) | 1 (0,3) | 0,007 |
* Из 305 пациентов информация о мутации генов BRCA была доступна для 228 пациентов, из которых 33 пациента являлись носителями мутаций генов BRCA1/BRCA2.
† Подсчитано при помощи теста Фишера.
В Таблице 3 приведены различия риска локорегионарного рецидива между группами с проведенным липофилингом и без него, разделенными на несколько подгрупп. В целом локорегионарный рецидив случался в 1,3 % в основной группе (9 из 719 молочных желез) и 2,4 % в контрольной группе (16 из 670 молочных желез) (p = 0,455). Мы обнаружили, что липофилинг не влиял на риск локорегионарного рецидива в подгруппах, различающихся по стадиям развития патологии, зонам локализации опухоли, мастэктомии, статуса рецепторов гормонов, перенесенной химиотерапии или лучевой терапии.
Мы также использовали многофакторную модель пропорциональной регрессии рисков Кокса, с помощью которой сравнивали локорегионарный рецидив в основной и контрольной группах с учетом проведенного вида терапии – химиотерапии, лучевой, гормональной терапии и клинической стадии (p = 0,348).
Единственная изученная подгруппа, в которой липофилинг ассоциировали с повышенным риском локорегионарного рецидива, была подгруппа, в которой пациенты получали гормональную терапию, 1,4 и 0,5 % для групп с липофилингом и без липофилинга соответственно (p = 0,038). Когда многофакторная модель пропорциональной регрессии рисков Кокса применялась только в отношении пациентов, получавших гормональную терапию (с учетом таких факторов, как химиотерапия, лучевая терапия и клиническая стадия), липофилинг все еще оставался существенным фактором повышенного риска локорегионарного рецидива (p = 0,031).
В Таблице 4 приведены различия рисков системного рецидива между группами с липофилингом и без него в нескольких подгруппах. В целом системный рецидив наблюдался в 2,4 % молочных желез в основной группе (17 из 719 молочных желез) и в 3,6 % молочных желез в контрольной группе (24 из 670 молочных желез) (p = 0,514). Не было существенной разницы в частоте системного рецидива опухолей между молочными железами, в отношении которых была проведена реконструкция с применением липофилинга или без него, в целом или в исследуемых подгруппах.
Таблица 3. Риск локорегионарных рецидивов рака молочной железы при липофилинге и без липофилинга в
различных подгруппах
| Группы с липофилингом | Контрольная группа |
|||
| Показатели | Липофилинг в образцах без рака в анамнезе, %* |
Липофилинг с раком в анамнезе, % |
Без липофилинга при раке в анамнезе, % |
p† |
| Количество молочных желез | 305 | 719 | 670 | |
| Локорегионарный рецидив | 0 (0) | 9 (1,3) | 16 (2,4) | 0,455 |
| Среднее время после мастэктомии до локорегионарного рецидива ± SD, мес. |
– | 80,7 ± 70 | 51,4 ± 64 | 0,417‡ |
| Среднее время от липофилинга до локорегионарного рецидива ± SD, мес. |
– | 19,3 ± 25 | – | – |
| Раса | ||||
| Европеоиды | 8 (1,5) | 12 (2,6) | 0,438 | |
| Афроамериканцы | 1 (2,4) | 2 (3,5) | 0,934 | |
| Латиноамериканцы | 0(0) | 2 (1,8) | 0,998 | |
| Азиаты | 0(0) | 0(0) | – | |
| Коренные американцы | 0(0) | 0(0) | – | |
| Вид мастэктомии | ||||
| Радикальная | 8 (1,3) | 11 (1,9) | 0,607 | |
| Сегментарная | 1 (1,3) | 4 (5,5) | 0,972 | |
| Гистологический тип Инвазия |
||||
| Протоковая | 6 (1,2) | 9 (1,9) | 0,299 | |
| Дольковая | 1 (1,6) | 1 (1,6) | 0,774 | |
| In situ | ||||
| DCIS | 0 (0) | 3 (5,4) | 0,997 | |
| LCIS | 0 (0) | 0 (0) | – | |
| Стадия патологии | ||||
| 0 | 1 (0,6) | 4 (3,5) | 0,541 | |
| I | 2 (0,8) | 6 (2,9) | 0,658 | |
| II | 4 (2) | 4 (1,6) | 0,271 | |
| III | 2 (3,1) | 1 (1,1) | 0,996 | |
| IV | 0 (0) | 0 (0) | – | |
| Расположение опухоли молочной железы (квадрант) | ||||
| Верхне-наружный | 2 (1,1) | 5 (2,7) | 5 (2,7) | |
| Верхне-внутренний | 0 (0) | 0 (0) | – | |
| Нижне-наружный | 1 (3,6) | 0 (0) | 0,998 | |
| Нижне-внутренний | 0 (0) | 2 (7,7) | 0,998 | |
| Центричность | ||||
| Мультифокальный | 1 (2,6) | 1 (2,5) | 0,997 | |
| Мультицентричный | 2 (2,5) | 1 (1,4) | 0,997 | |
| Статус рецептора гормонов | ||||
| ER+ | 6 (1,) | 6 (1,2) | 0,330 | |
| PR+ | 2 (0,5) | 5 (1,3) | 0,633 | |
| HER2-neu+§ | 1 (2,2) | 0 (0) | 0,998 | |
| Ki67+‖ | 2 (1,2) | 2 (1,1) | 0,162 | |
| Химиотерапия | ||||
| Любая | 8 (1,8) | 9 (1,9) | 0,099 | |
| Неоадъювантная | 5 (2,3) | 2 (0,8) | 0,053 | |
| Вспомогательная | 6 (2,3) | 8 (3,1) | 0,317 | |
| Лучевая терапия ¶ | ||||
| Любая | 5 (1,7) | 4 (1,4) | 0,760 | |
| Неоадъювантная | 5 (1,7) | 4 (1,4) | 0,760 | |
| Гормональная терапия # | ||||
| Любая | 9 (1,4) | 2 (0,5) | 0,038 | |
| Тамоксифен | 4 (1,5) | 2 (0,8) | 0,151 | |
| Ралоксифен | 0 (0) | 0 (0) | – | |
| Гозерелин | 0 (0) | 0 (0) | – | |
| Летрозол | 2 (3,4) | 0 (0) | – | |
| Флуоксиместерон | 0 (0) | 0 (0) | – | |
| Эксеместан | 0 (0) | 0 (0) | – | |
| Анастрозол | 3 (1,9) | 0 (0) | – | |
| Лейпрорелин | 0 (0) | 0 (0) | – | |
| Торемифен | 0 (0) | 0 (0) | – | |
| Количество сеансов липофилинга | ||||
| 1 | 7 (1,3) | 0 (0) | ||
| 2 | 1 (0,8) | 0 (0) | – | |
| ≥ 3 | 0 (0) | 0 (0) | – | |
| Общий объем введенного жира | ||||
| 1–100 cc | 7 (1,6) | – | – | |
| 101–200 cc | 1 (0,6) | – | – | |
| 201–300 cc | 0 (0) | – | – | |
| 301–400 cc | 0 (0) | – | – | |
| 401–500 cc | 0 (0) | – | – | |
| > 500 cc | 0 (0) | – | – | |
ER, рецептор эстрогена; PR, рецептор прогестерона; +, положительный;
DCIS, протоковая карцинома in situ; LCIS, долькова карцинома in situ
* Из 305 пациентов информация о мутации генов BRCA была доступна для 228 пациентов, 33 из которых имели мутацию генов BRCA1/BRCA2 (среднее время наблюдения после мастэктомии, 33,6 мес.; среднее время до липофилинга, 18,4 мес.).
† p-значения подсчитывались при помощи зависимой от времени многофакторной модели пропорциональной регрессии рисков Кокса.
‡ Разница во времени от мастэктомии до локорегионарного рецидива тестировали при помощи t-критерия Уилкоксона.
§ ≥ 2 при иммуногистохомии; подтверждено флуоресцентной гибридизации in situ.
‖ Экспрессия > 17 %.
¶ Метод лучевой терапии одинаков для обеих групп.
# Средняя продолжительность гормональной терапии составляла 28,3 месяца
Как показано на Рисунке 1, суммарная частота 3‒5-летнего рецидива составляла 0,3 и 1,6 % соответственно для основной группы (с липофилингом) и 1,3 и 4,1 % соответственно для контрольной группы (без липофилинга). Частота локорегионарного рецидива составляла 0,25 на 100 человек в год в основной группе и 0,65 на 100 человек в год в контрольной группе (p = 0,455).
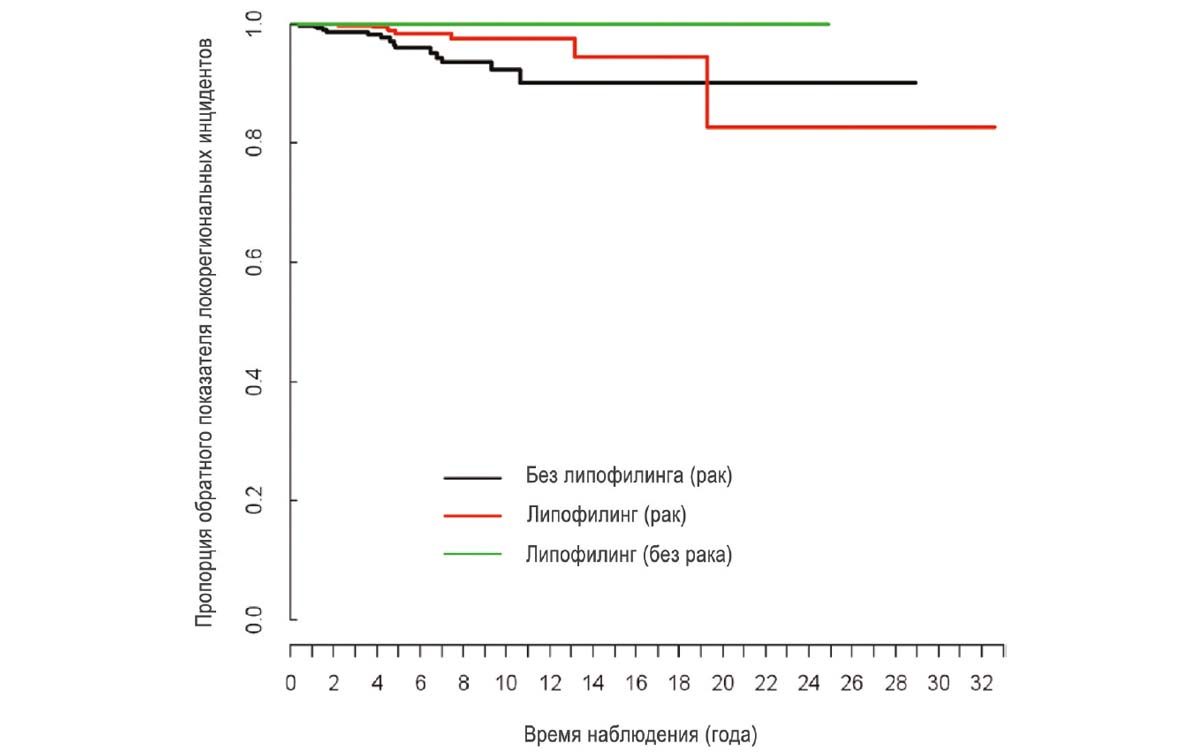
Рисунок 1. Кривая выживаемости Каплана – Мейера без локорегионарного рецидива в основной группе (рак и липофилинг), контрольной группе (рак без липофилинга) и молочных желез без рака в анамнезе с липофилингом
В 305 здоровых молочных железах, подвергнутых реконструкции с применением липофилинга после профилактической мастэктомии, случаев рака молочной железы за время наблюдения не выявлялось.
В отличие от предыдущих исследований, оценивавших частоту рецидивов рака молочной железы у пациентов, которым липофилинг был проведен в связи с реконструкцией после мастэктомии, наше исследование включало контрольную группу. Кроме того, наше исследование рассматривало больше пациентов, чем предыдущие. В ходе исследования мы выявили существенные различия в частоте локорегионарного и системного рецидивов между молочными железами, подвергнутыми реконструкции с липофилингом и без него.
Мы также сравнивали частоту локорегиональных рецидивов в молочных железах после реконструкции с липофилингом и без него в нескольких подгруппах, выделенных в зависимости от клинических, патологических характеристик и характеристик липофилинга, и обнаружили, что локорегионарный рецидив при реконструкции с применением липофилинга был выше только в подгруппе пациентов, получавших гормональную терапию.
Мы также не выявили никаких признаков развития первичного рака в здоровых молочных железах, реконструированных при помощи липофилинга, включая 33 пациента ‒ носителя мутаций генов BRCA1/BRCA2. Растущую популярность аутотрансплантации жира подтверждает значительный рост числа опубликованных статей по этой теме.
Нам удалось найти две статьи о трансплантации жира при реконструкции молочных желез, опубликованные в 1993 году, тогда как в 2013 году на эту тему было опубликовано свыше 120 статей. Многие из известных ранее исследований были сосредоточены на технических аспектах серийной трансплантации жира, в том числе количестве сеансов трансплантации, необходимых для введения общего объема, обычно применяемого для реконструкции молочных желез.
Одно из исследований изучало тенденции трансплантации жира через национальные опросы членов Американского общества пластических хирургов (456 из 2584 членов Общества прислали заполненные анкеты) [1]. В этом исследовании 62 % респондентов сообщали о том, что используют трансплантацию жира при реконструктивной хирургии молочных желез. 28 % респондентов сообщали о применении трансплантации жира при эстетической хирургии молочных желез, а 59 % респондентов не проводили трансплантацию жира в эстетической хирургии и не планировали делать это в будущем.
На вопрос о потенциальных препятствиях к введению трансплантации жира в клиническую практику 49 % респондентов «уверенно соглашались» или «соглашались», что недостаточность доказательств относительно влияния трансплантации жира в молочные железы на развитие рака молочных желез или рецидив являлся для них препятствием. Для преодоления этого препятствия, чтобы 100 % хирургов могли уверенно применять трансплантацию жира в своей практике, сначала необходимо выяснить, какие физиологические процессы происходят, когда мы вводим жир в молочную железу пациента.
Rigotti и соавторы в 2007 году пояснили, как липоаспират способствует восстановлению подвергнутых облучению тканей через процесс, вызываемый зрелыми стволовыми клетками подкожно-жировой клетчатки [6]. Ультраструктурный анализ липоаспирата выявил хорошо сохранившийся стромально-васкулярный компонент. Однако хорошо сохранившиеся адипоциты практически отсутствовали.
Цитологические характеристики липоаспирата путем анализа in vitro показали, что мезенхимальные стволовые клетки соответствовали мезенхимальным стволовым клеткам костного мозга. Через 4‒6 месяцев после инъекции липоаспирата пациенту адипоциты были в норме и микрососудистая сеть показывала нормальную ультраструктуру. Через год и более после процедуры картина значительно не менялась, за исключением тенденции к сжатию межклеточного пространства, адипоциты были в норме, микроциркуляция проходила нормально.
Разумеется, эта информация должна служить клиницистам рекомендацией выдерживать 4‒6-месячный интервал между сеансами трансплантации жира. Кроме того, данное исследование выявило, что медианное время от липофилинга до выявления локорегионарного рецидива (19 месяцев) не было напрямую связано с завершением процесса созревания сосудистой сети и межклеточного пространства.
При рассмотрении вопроса о безопасности трансплантации жира требуется подтвердить информацию о взаимосвязи трансплантации жира и ложи опухоли. Гипотетически трансплантация стволовых клеток жировой ткани или мезенхимальных стволовых клеток подкожно-жировой клетчатки может спровоцировать пробуждение «спящих» раковых клеток и таким образом стимулировать рецидив у пациента.
Исследования in vitro, а также опыты, проведенные с участием животных, дали противоречивые выводы относительно влияния стволовых клеток: некоторые результаты показывали положительную, другие отрицательную связь с пролиферацией клеток рака молочной железы.
Petit и коллеги опубликовали Европейское ретроспективное мультиинституциональное исследование 646 случаев липофилинга груди и обнаружили, вызвав обеспокоенность многих хирургов, что риск рецидива рака молочной железы был выше у пациентов с карциномой in situ, чем у пациентов с инвазивным раком молочной железы [7].
В контрольном ретроспективном исследовании (59 пациентов) Petit и соавторы фокусировались только на пациентах с карциномой in situ в груди и обнаружили, что у тех, кому был проведен липофилинг, суммарный 5-летний риск локорегионарного рецидива, составлял 18 %, тогда как суммарный 5-летний риск у пациентов, не проходивших липофилинг, только 3 % [8].
Важный фактор, на который следует обратить внимание в обоих исследованиях Petit и соавторов, заключался в том, что большой процент пациентов, прошедших терапию с сохранением молочной железы, получали только интраоперационное облучение. В отличие от выводов Petit и коллег [7, 8] мы наблюдали только 25 локализованных регионарных рецидивов (1,5 %) и частоту общих локорегионарных рецидивов ‒ 1,3 % у раковых пациентов, прошедших липофилинг, и 2,4 % у раковых пациентов без липофилинга.
Кроме того, мы не обнаружили различий в суммарной частоте 5-летнего локорегионарного рецидива между раковыми пациентами с липофилингом (1,6 %; 0,25 случаев на 100 человек в год) и раковыми пациентами без липофилинга (4,1 %; 0,65 случаев на 100 человек в год). Наши результаты были схожи с выводами недавнего проспективного исследования Brenelli и соавторов, изучавших 59 пациентов [9], в котором было обнаружено, что только три пациента (частота 4 %) имели рецидив рака молочной железы с предполагаемой ежегодной частотой рецидива 1,3 % в год.
Теоретически сегментарная мастэктомия должна ассоциироваться с наиболее высоким риском локорегионарного рецидива после липофилинга, поскольку большая часть ткани молочной железы сохранена, однако в ранее упомянутом проспективном исследовании 59 пациентов [9], все три пациента с рецидивом рака молочной железы, имели инвазивные первичные опухоли и инвазивные рецидивы.
В отличие от исследования Petit и соавторов [7, 8] , как и в проспективном исследовании 59 пациентов [9], мы не обнаружили существенных различий в риске локорегионарного рецидива между молочными железами, реконструированными при помощи липофилинга и без него, независимо от того, был ли рак молочной железы инвазивным или внутрипротоковым.
Мы не увидели существенной разницы рисков рецидива рака молочной железы между молочными железами, которые лечили при помощи сегментарной мастэктомии, и молочными железами после радикальной мастэктомии и липофилинга. Мы также не обнаружили существенной разницы в частоте рецидива, когда сопоставляли сегментарную или радикальную мастэктомию с липофилингом индивидуально с контрольной группой.
Единственной переменной, которая значительно увеличивала риск рецидива рака молочной железы с липофилингом, была гормональная терапия. Хотя более вероятным получение гормональной терапии было в основной, а не в контрольной группе. Молочные железы основной и контрольной групп имели схожий статус гормональных рецепторов.
Восемь из 805 пациентов, получавших гормональную терапию, имели локорегионарный рецидив. Из них в основной группе частота локорегионарного рецидива была примерно в 3 раза выше, чем в контрольной. Гипотетическая потенциальная роль гормональной терапии в усилении туморогенной микросреды или влияние на связи мезенхимальных стволовых клеток подкожно-жировой клетчатки с раковыми клетками молочной железы неизвестно, если опираться на современные научные знания.
Хотя липоаспират является известным резервуаром мезенхимальных стволовых клеток подкожно-жировой клетчатки, сами по себе они не являются туморогенными, поскольку не способны вызывать неопластическую трансформацию нормальных клеток молочной железы. Однако неизвестно, могут ли мезенхимальные стволовые клетки подкожно-жировой клетчатки обострять туморогенное поведение раковых клеток, теоретически создавая воспалительную микросреду, которая поддерживает рост опухоли и ангиогенез [10].
Интересно, что мы также обнаружили, что ни общий объем введенного жира, ни число сеансов трансплантации жира не содействовали локорегионарному рецидиву. Однако мы обнаружили, что больший объем жира для трансплантации требовался для молочных желез с раком в анамнезе, чем для здоровых желез. Для нашего исследования было важно понять, какие характеристики были схожими для основной и контрольной групп.
Хотя между основной и контрольной группами имелись некоторые различия, в частности, в основной группе период наблюдения был более длительным, возраст пациентов немного выше, чаще встречались 0-1 стадии рака молочной железы, преобладала гормональная терапия, в обеих группах был схожий статус гормональных рецепторов; разница между клинико-патологическими характеристиками в группах уравновешивала их в плане вероятности риска локорегионарного рецидива.
Например, более поздние стадии заболевания (больший риск рецидива) и больший объем полученной химиотерапии (более агрессивная терапия), характерные для контрольной группы, балансировали более длительный период наблюдения (более высокий риск выявления рецидива) и больший объем полученной гормональной терапии (менее агрессивное лечение) в основной группе.
Результаты данного исследования не показали увеличения частоты возникновения локорегионарного рецидива, системного рецидива или второго случая рака молочной железы и поддерживают гипотезу онкологической безопасности трансплантации жировой ткани при реконструкции молочных желез.
Хотя получение гормональной терапии действительно существенно увеличивало риск локорегионарного рецидива рака молочной железы у пациентов, которым проводился липофилинг, по сравнению с пациентами, которым он не проводился, частота рецидива была низкой.
Перед тем как отказаться от липофилинга как метода реконструкции для пациентов, перенесших рак молочных желез, и получавших гормональную терапию, для выявления действительной клинической значимости было бы более чем уместно провести рандомизированное исследование.
Steven J. Kronowitz, M.D. Kronowitz Plastic Surgery, PLLC 1200 Binz, Suite 380 Houston, Texas 77004 steven@kronowitzplasticsurgery.com
Онкологический центр Техасского университета Андерсона (The University of Texas M. D. Anderson Cancer Center) частично поддерживается Национальными институтами здравоохранения (National Institutes of Health) за счет гранта (CA016672) Онкологического центра. Авторы благодарят Melissa Crosby, M.D., за вклад в данное исследование.
1. Kling RE, Mehrara BJ, Pusic AL, et al. Trends in autologous fat grafting to the breast: A national survey of the American Society of Plastic Surgeons. Plast Reconstr Surg. 2013;132:35–46.
2. Gutowski KA. Current applications and safety of autologous fat grafts: A report of the ASPS fat graft task force. Plast Reconstr Surg. 2009;124:272–280.
3. Zhang Y, Daquinag A, Traktuev DO, et al. White adipose tissue cells are recruited by experimental tumors and promote cancer progression in mouse models. Cancer Res. 2009;69:5259–5266.
4. Price JE, Polyzos A, Zhang RD, et al. Tumorigenicity and metastasis of human breast carcinoma cell lines in nude mice. Cancer Res. 1990;50:717–721.
5. Delay E, Garson S, Tousson G, et al. Fat injection to the breast: Technique, results, and indications based on 880 procedures over 10 years. Aesthet Surg J. 2009;29:360–376.
6. Rigotti G, Marchi A, Galie M, et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: A healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg. 2007;119:1409–1422.
7. Petit JY, Lohsiriwat V, Clough KB, et al. The oncologic outcome and immediate surgical complications of lipofilling inbreast cancer patients: A multicenter study. Milan-Paris-Lyon experience of 646 lipofilling procedures. Plast Reconstr Surg. 2011;128:341–346.
8. Petit JY, Rietjens M, Botteri E, et al. Evaluation of fat grafting safety in patients with intraepithelial neoplasia: A matchedcohort study. Ann Oncol. 2013;24:1479–1484.
9. Brenelli F, Rietjens M, De Lorenzi F, et al. Oncological safety of autologous fat grafting after breast conservative treatment: A prospective evaluation. Breast J. 2014;20:159–165.
10. Eterno V, Zambelli A, Pavesi L, et al. Adipose-derived mesenchymal stem cells (ASCs) may favour breast cancer recurrence via HCF/c-Met signaling. Oncotarget 2014;5:613–633.


